Buste de l'ambassadeur Kosa Pan
Bust of Ambassador Kosa Pan
 Kosa Pan fut l’ambassadeur du royaume de Siam venu en France rencontrer le roi Louis XIV à Versailles en 1688. En l’honneur de cette visite, une rue de Brest fut d’ailleurs baptisée « Rue de Siam ».
Kosa Pan fut l’ambassadeur du royaume de Siam venu en France rencontrer le roi Louis XIV à Versailles en 1688. En l’honneur de cette visite, une rue de Brest fut d’ailleurs baptisée « Rue de Siam ».
En mémoire de cette visite, la société des professeurs de français de Thaïlande (nom actuel du Siam) a fait don d’un buste de cet ambassadeur à la ville de Brest et il fut inauguré en février 2020.
En juillet 2020, le buste de Kosa Pan, fut subtilisé le temps d’une nuit. Afin de rendre toute autre action similaire plus difficile, le buste et son piédestal en granite furent placés sur un socle constitué d’un granite identique à celui du piédestal.
Au travers cette cache, vous allez pouvoir découvrir cet ensemble et constater une dégradation visible à la surface de la roche.
 Kosa Pan was the ambassador of the kingdom of Siam who came to France to meet King Louis XIV in Versailles in 1688. In honor of this visit, a street in Brest was named "Rue de Siam".
Kosa Pan was the ambassador of the kingdom of Siam who came to France to meet King Louis XIV in Versailles in 1688. In honor of this visit, a street in Brest was named "Rue de Siam".
In memory of this visit, the Society of French Teachers of Thailand (the current name of Siam) donated a bust of this ambassador to the city of Brest and it was inaugurated in February 2020.
In July 2020, the bust of Kosa Pan, was stolen for a night. In order to make any other similar action more difficult,the bust and its granite pedestal were placed on a base made of an identical granite as the pedestal.
Through this cache, you will discover this ensemble and notice a visible degradation on the surface of the rock.
Quelques concepts / Few concepts
 Ion, anion et cation
Ion, anion et cation
Dans un atome neutre, le nombre de protons = le nombre d'électrons. Un ion est un atome, ou un groupe d'atomes, ayant perdu ou gagné un ou plusieurs électrons.
Un anion est un atome (ou une molécule) qui a gagné un ou plusieurs électrons. Comme l'électron est chargé négativement, l'anion porte une charge négative. Il s’agit donc d’un ion négatif.

À l'inverse, un cation est un atome (ou une molécule) qui a perdu un ou plusieurs électrons. La charge électrique globale du cation est donc positive. Il s’agit donc d’un ion positif.
Les ions sont notés en tenant compte de la différence entre le nombre de protons et le nombre d'électrons. Dans la version « simple », on écrira Xn+ et Xn- pour respectivement, un ion qui porte une charge positive (cation) car plus de protons que d’électrons et un ion qui porte une charge négative (anion) car moins de protons que d’électron. Ex : Na+ ou OH- (on n’écrit pas n=1).
 Ion, anion and cation
Ion, anion and cation
In a neutral atom, the number of protons = the number of electrons. An ion is an atom, or a group of atoms, that has lost or gained one or more electrons.
An anion is an atom (or a molecule) that has gained one or more electrons. As the electron is negatively charged, the anion has a negative charge. It is therefore a negative ion.
Conversely, a cation is an atom (or molecule) that has lost one or more electrons. The overall electrical charge of the cation is therefore positive. It is therefore a positive ion.
Ions are noted by taking into account the difference between the number of protons and the number of electrons. In the "basic" version, we write Xn+ and Xn- for respectively, an ion that carries a positive charge (cation) because it has more protons than electrons and an ion that carries a negative charge (anion) because it has less protons than electrons. Ex : Na+ or OH- (we do not write n=1).
- - -
 Oxydation, réduction, nombre d’oxydation, oxydant, réducteur et … patati et patata !
Oxydation, réduction, nombre d’oxydation, oxydant, réducteur et … patati et patata !
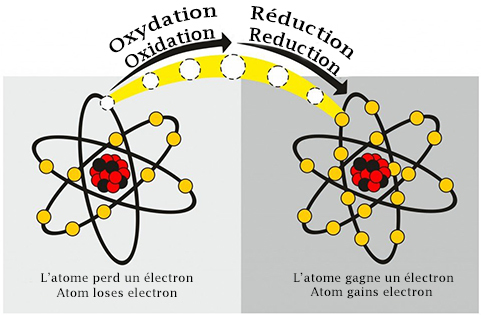 L'oxydation est un phénomène courant ; une pomme brunie ou un clou rouillé sont deux exemples courants de réactions d'oxydation. L'oxydation ne signifie pas qu'un atome d'oxygène est ajouté au composé. Il s'agit plutôt d'une réaction chimique qui implique la perte d'électrons.
L'oxydation est un phénomène courant ; une pomme brunie ou un clou rouillé sont deux exemples courants de réactions d'oxydation. L'oxydation ne signifie pas qu'un atome d'oxygène est ajouté au composé. Il s'agit plutôt d'une réaction chimique qui implique la perte d'électrons.
Cet électron perdu ne se promène pas sans but dans l'univers ; il est pris en charge par un autre atome. Lorsqu'un atome accepte un électron, il s'agit d'une réaction de réduction. L'oxydation et la réduction vont de pair et sont appelées conjointement des réactions d'oxydoréduction (souvent appelées redox).
Le nombre d'oxydation, également appelé état d'oxydation, est le nombre total d'électrons qu'un atome gagne ou perd afin de former une liaison chimique avec un autre atome.
Les atomes neutres isolés (corps à l’état élémentaire) ont par définition un nombre d’oxydation nul. Si un atome donne (perd) un électron, on dit qu'il a un nombre d'oxydation (n.o.) égal à un +I ; s'il en donne deux, n.o. = +II, etc. Réciproquement, si un atome accepte (reçoit) un électron, son nombre d'oxydation devient -I ; s'il en accepte deux, n.o. = −II, etc.
Le nombre d’oxydation maximal est +VII et le nombre minimal est –II.
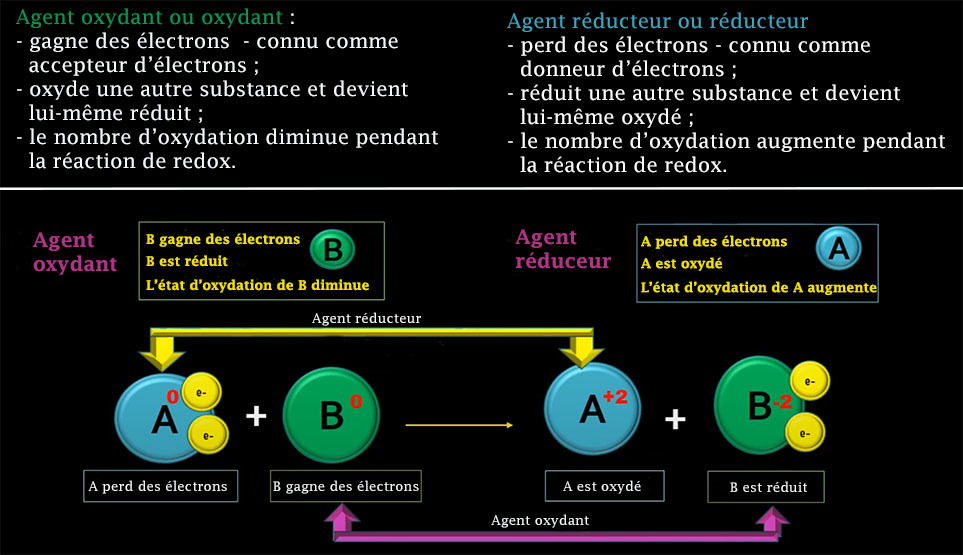
Un oxydant, ou agent oxydant ou agent d'oxydation, est un corps simple, un composé ou un ion qui reçoit au moins un électron d'une autre espèce chimique lors d'une réaction d'oxydoréduction. L'oxydant ayant accepté au moins un électron au cours de cette réaction est dit réduit, tandis que l'espèce chimique qui a cédé au moins un électron est dite oxydée. Un oxydant est généralement proche de son état d'oxydation le plus élevé et se comporte par conséquent comme un accepteur d'électron.
Un réducteur est un corps simple, un composé ou un ion qui cède au moins un électron à une autre espèce chimique lors d'une réaction d'oxydoréduction. Le réducteur ayant perdu au moins un électron au cours de cette réaction est dit oxydé, tandis que l'espèce chimique qui a reçu au moins un électron est dite réduite. Un réducteur est généralement proche de son état d'oxydation le plus faible et se comporte par conséquent comme un donneur d'électron.
Les métaux sont généralement considérés comme des éléments qui peuvent facilement perdre des électrons, ils sont donc connus pour être facilement oxydés.
 Oxidation, reduction, oxidation number, oxidant, reductant and do on and so forth
Oxidation, reduction, oxidation number, oxidant, reductant and do on and so forth
Oxidation is a common phenomenon; a browned apple or a rusty nail are both common examples of oxidation reactions. Oxidation does not mean that an oxygen atom is added to the compound. Instead, it is a chemical reaction that involves the loss of electrons.
This lost electron does not wander around in the universe aimlessly; it is taken up by another atom. When one atom accepts an electron, it is called a reduction reaction. Oxidation and reduction go hand-in-hand and are jointly referred to as redox reactions.
The oxidation number, also called the oxidation state, is the total number of electrons that an atom gains or loses in order to form a chemical bond with another atom.
Isolated neutral atoms (elementary material) have by definition an oxidation number of zero. If an atom gives (loses) one electron, it is said to have an oxidation number ( o.n.) equal to +I; if it gives two, o.n. = +II, etc. Reversely, if an atom accepts (receives) an electron, its oxidation number becomes -I; if it accepts two, n.o. = -II, etc.
The maximum oxidation number is +VII and the minimum is -II.
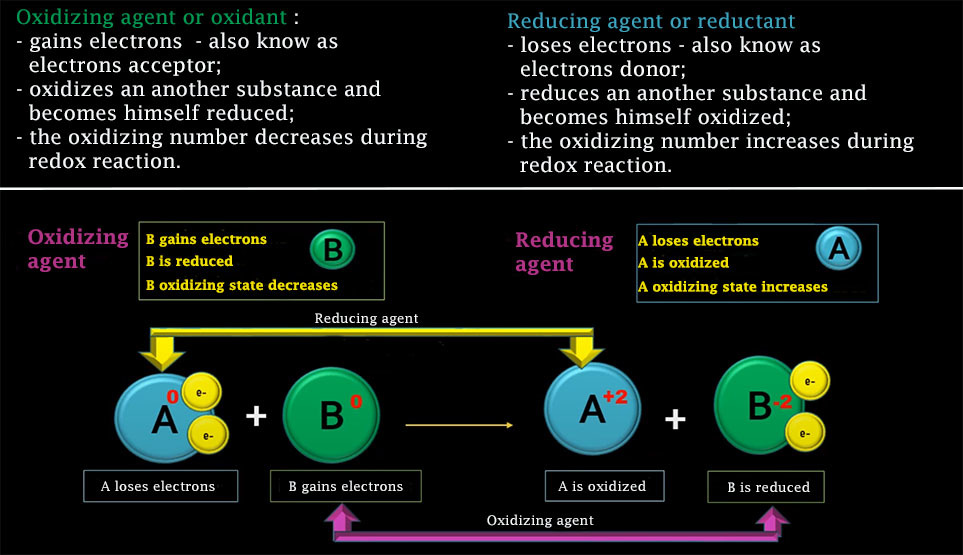
An oxidizing agent, or oxidant, is a simple body, compound or ion that receives at least one electron from another chemical species during a redox reaction. The oxidant agent that has accepted at least one electron during this reaction is said to be reduced, while the chemical species that has given up at least one electron is said to be oxidized. An oxidant agnet is usually close to its highest oxidation state and therefore behaves as an electron acceptor.
A reducing agent, or reductant, is a simple body, compound or ion that gives up at least one electron to another chemical species in a redox reaction. The reductant that has lost at least one electron during this reaction is said to be oxidized, while the chemical species that has received at least one electron is said to be reduced. A reducing agent is generally close to its weakest oxidation state and therefore behaves like an electron donor.
Metals are generally considered to be elements that can easily lose electrons, so they are known to be easily oxidized.
- - -
 Roche
Roche
 En géologie, une roche (ou pierre) est une masse solide naturelle ou un agrégat de minéraux et qui comporte parfois des fossiles. Elle est classée en fonction des minéraux qu'elle contient, de sa composition chimique et de la manière dont elle s'est formée.
En géologie, une roche (ou pierre) est une masse solide naturelle ou un agrégat de minéraux et qui comporte parfois des fossiles. Elle est classée en fonction des minéraux qu'elle contient, de sa composition chimique et de la manière dont elle s'est formée.
 Rock
Rock
In geology, a rock (or stone) is any naturally occurring solid mass or aggregate of minerals and sometimes includes fossils. It is categorized by the minerals included, its chemical composition and the way in which it is formed.
- - -
 Types de roches
Types de roches
 Trois types de roches forment principalement l’écorce terrestre : les roches sédimentaires constituées de sédiments meubles qui se sont transformés (consolidés) au cours de l’évolution géologique ; les roches ignées (ou magmatiques) qui résultent de la solidification du magma, roche fondue sous l'action de la chaleur et de la pression dans les couches profondes de l'écorce terrestre ou dans la couche supérieure du manteau ; les roches métamorphiques issues d’une une transformation à l'état solide de roches sédimentaires, ignées ou… métamorphiques et provoquée par une modification de pression, de température…
Trois types de roches forment principalement l’écorce terrestre : les roches sédimentaires constituées de sédiments meubles qui se sont transformés (consolidés) au cours de l’évolution géologique ; les roches ignées (ou magmatiques) qui résultent de la solidification du magma, roche fondue sous l'action de la chaleur et de la pression dans les couches profondes de l'écorce terrestre ou dans la couche supérieure du manteau ; les roches métamorphiques issues d’une une transformation à l'état solide de roches sédimentaires, ignées ou… métamorphiques et provoquée par une modification de pression, de température…
 Rock types
Rock types
There are three main types of rocks which constitute the earth's crust: sedimentary rocks made up of loose unconsolidated sediment that have been transformed into rock during geological history; igneous (or magmatic) rocks, the product of the solidification of magma, which is molten rock generated by partial melting caused by heat and pressure in the deeper part of the Earth's crust or in the upper mantle; metamorphic rocks resulting from a transformation to a solid state of sedimentary, igneous or... metamorphic rocks and caused by a change of pressure, temperature...
- - -
 Granite
Granite
Le granite est une roche ignée (ou magmatique) résultant d’un magma remonté depuis les profondeurs de la terre sans avoir subi l’éruption. Au cours de son voyage, le magma va refroidir et se solidifier tranquillement pour aboutir à une roche dure et massive.
 Même s’il existe d’innombrables types/genres/sortes de granites, ils peuvent facilement être identifiés, car une de leurs caractéristiques principales est leur structure granulaire (en grains).
Même s’il existe d’innombrables types/genres/sortes de granites, ils peuvent facilement être identifiés, car une de leurs caractéristiques principales est leur structure granulaire (en grains).
Si de nos jours le granite est visible ou s’il peut être extrait de carrières, cela provient de mouvements tectoniques et/ou de l’érosion des roches qui initialement le recouvraient.
 Granite
Granite
Granite is an igneous (or magmatic) rock resulting from magma rising from the depths of the Earth but not erupting. During its trip, the magma will cool and solidify slowly to become a hard and massive rock.
Despite the fact that there are countless types/genres/sorts of granites, they can be easily identified, as one of their main characteristics is their granular (grain) structure.
If granite is visible today or if it can be extracted from quarries, this is due to tectonic movements and/or erosion of the rocks that originally covered it.
- - -
 Composition des granites
Composition des granites
 Un granite est principalement composé de quartz, de feldspath et de mica. Les deux premiers minéraux ont tendances à être clairs. Le quartz est de couleur grise, d’aspect mat et translucide. Si le feldspath est rose, il s’agit d’orthose; s’il est blanc laiteux et d’aspect brillant, il s’agit alors d’albite. La muscovite est un mica blanc brillant d’un aspect nacré et la biotite est un mica noir ou brun foncé, brillant et millimétrique. La tourmaline est aussi parfois un des composants des granites, mais il s’agit d’un minéral accessoire en forme de bâtonnet.
Un granite est principalement composé de quartz, de feldspath et de mica. Les deux premiers minéraux ont tendances à être clairs. Le quartz est de couleur grise, d’aspect mat et translucide. Si le feldspath est rose, il s’agit d’orthose; s’il est blanc laiteux et d’aspect brillant, il s’agit alors d’albite. La muscovite est un mica blanc brillant d’un aspect nacré et la biotite est un mica noir ou brun foncé, brillant et millimétrique. La tourmaline est aussi parfois un des composants des granites, mais il s’agit d’un minéral accessoire en forme de bâtonnet.
En règle générale, plus les cristaux sont gros, plus le refroidissement a été lent. Lorsque le refroidissement est suffisamment lent, les cristaux peuvent être de taille centimétrique (1 à 5 cm), ils sont alors appelés phénocristaux. La roche sera alors qualifiée de porphyroïde ou porphyrique. Ces phénocristaux sont généralement des cristaux de feldspath brillants, de couleur blanc (albite) ou rose (orthose), donnant une texture porphyroïde (ou porphyrique) au granite.
 Composition of granites
Composition of granites
 Granite is mainly made from quartz, feldspar and mica. The two first minerals tend to be clear. Quartz is gray in color, matte and translucent in appearance. If the feldspar is pink, then it's orthoclase; if it's milky white and shiny, then it's albite. Muscovite is a bright white mica with a pearly appearance and biotite is a bright black mica with a millimeter size. Tourmaline is sometimes one of the components of granites, but it's a rod-shaped accessory mineral.
Granite is mainly made from quartz, feldspar and mica. The two first minerals tend to be clear. Quartz is gray in color, matte and translucent in appearance. If the feldspar is pink, then it's orthoclase; if it's milky white and shiny, then it's albite. Muscovite is a bright white mica with a pearly appearance and biotite is a bright black mica with a millimeter size. Tourmaline is sometimes one of the components of granites, but it's a rod-shaped accessory mineral.
Generally, the larger the crystals, the slower the cooling. When the cooling is slow enough, the crystals can be centimetric size (1 to 5 cm), they are then called phenocrysts. The rock will then be qualified as porphyroid or porphyritic. These phenocrysts are generally bright feldspar crystals, white (albite) or pink (orthose), giving a porphyroid (or porphyritic) texture to the granite.
- - -
 Le fer
Le fer
Le fer, un métal de symbole chimique Fe, est l’un des éléments les plus abondants de la croûte terrestre. Il existe sous plusieurs formes de degré d'oxydation allant de -II à +VII ; cependant, il est principalement présent sous forme +II ou +III.
Le fer, à l’état naturel, existe donc sous deux formes oxydées :
- l’oxyde de fer(II) appelé aussi « fer ferreux », noté Fe(II) mais aussi Fe2+ pour l’ion ferreux. Il est souvent présent sous forme soluble (comme le sucre ou le sel dans l’eau) dans les roches et l’acidité de la roche favorise sa solubilité.
- l’oxyde de fer(III) appelé aussi « fer ferrique » ; noté Fe(III) mais aussi Fe3+pour l’ion ferrique. Il est parfois présent sous forme soluble dans les roches. Un environnement acide favorise sa solubilité.
Fe(II) et Fe(III) n'existent pas seuls, mais au sein d'une molécule : Fe3O4, Fe2CO3, FeS2 ...
On peut aussi le trouver sous forme métallique - Fe(0) - qui est le résultat d’un fer transformé par les activités humaines à partir de minerais de fer.
 Iron
Iron
Iron, chemical symbol Fe, is one of the most abundant elements in the earth's crust. It exists in several forms of oxidation degree going from -II to +VII; however, it is mainly present in the +II or +III form.
Iron, in its natural state, exists in two oxidized forms:
- iron(II) oxide also called "ferrous iron", noted Fe(II) but also Fe2+ for ferrous ion. It is often present in soluble form (like sugar or salt in water) in rocks and the acidity of the rock favors its solubility.
- Iron(III) oxide also called "ferric iron"; noted Fe(III) but also Fe3+ for ferric ion. It's sometimes found in soluble form in rocks. An acidic environment makes it more soluble.
Fe(II) and Fe(III) do not exist alone, but within a molecule: Fe3O4, Fe2CO3, FeS2 ...
It can also be found in metallic form - Fe(0) – which is the result of iron transformed by human activities from iron ores.
- - -
 Oxydation et réduction du fer
Oxydation et réduction du fer
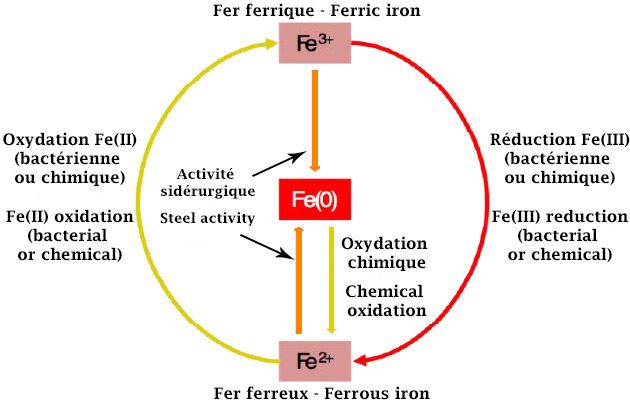 L’oxydation ou la réduction du fer peut s’opérer de deux manières : chimiquement de façon naturelle ou biochimiquement, et les deux peuvent être associées. Ce sont les conditions initiales ainsi que l’environnement ou le milieu qui vont déterminer le type de réaction dont le fer va faire l’objet.
L’oxydation ou la réduction du fer peut s’opérer de deux manières : chimiquement de façon naturelle ou biochimiquement, et les deux peuvent être associées. Ce sont les conditions initiales ainsi que l’environnement ou le milieu qui vont déterminer le type de réaction dont le fer va faire l’objet.
Lorsqu’il est sous forme dissoute (état ionique Fe2+) et dans un environnement oxique* neutre (comme l'air ou l'eau) dépourvu d’organismes vivants, le fer peut être oxydé pour prendre la forme d‘un oxyde ferrique solide (état ionique Fe3+). Si l’environnement oxique est acide, alors le fer dissout (état ionique Fe2+) pourra être oxydé pour prendre la forme d’un oxyde ferrique également dissout (état ionique Fe3+).
La présence d’organismes vivants, dont les bactéries, peut provoquer des réactions d’oxydoréduction qui n’auraient pas eu lieu sans la présence de ces organismes.
 Sans la présence de certaines bactéries ayant des propriété ferro-oxydantes, c’est l’oxygène (le dioxygène – O2 – plus précisément), contenu dans l’air ou dans l’eau, qui va permettre l’oxydation du fer. Ne pouvant plus être contenu dans le milieu sous sa nouvelle forme, il va précipiter pour apparaître sous cette forme.
Sans la présence de certaines bactéries ayant des propriété ferro-oxydantes, c’est l’oxygène (le dioxygène – O2 – plus précisément), contenu dans l’air ou dans l’eau, qui va permettre l’oxydation du fer. Ne pouvant plus être contenu dans le milieu sous sa nouvelle forme, il va précipiter pour apparaître sous cette forme.
Lorsqu’il s’agit d’une roche, la présence de fer ferrique (Fe(III)/Fe3+) est remarquable par une coloration rouille ou par des nuances orangées, beiges, brunes, violacées ou encore rosâtres de la roche. Mais la réciproque n’est pas forcément vraie. Certaines de ces nuances peuvent provenir d’uranium, de mercure ou encore d’autres minéraux qui auront subi divers processus chimiques.
*Un milieu est oxique s’il contient de l’oxygène sous forme gazeuse ou sous forme dissoute.
 Oxidation and reduction of iron
Oxidation and reduction of iron
Oxidation or reduction of iron can occur in two modes: chemically in a natural way or biochemically, and the two can be combined. The initial conditions as well as the environment or the background will determine the type of reaction that iron will undergo.
When it is in dissolved form (ionic state Fe2+) and in a neutral (like air or water) oxic* environment devoid of living organisms, iron can be oxidized to a solid iron oxide (ionic state Fe3+). If the oxic environment is acidic, then the dissolved iron (ionic state Fe2+) can be oxidized to take the form of a ferric oxide also dissolved (ionic state Fe3+).
The presence of living organisms, including bacteria, can trigger redox reactions that would not have occurred without the presence of these organisms.
 Without presence of specific bacteria with ferro-oxidizing properties, it is the oxygen (dioxygen - O2 - more precisely) found in the air or in water, which will allow oxidation of iron. No longer able to be contained in the environment in its new form, it will precipitate to appear in this form.
Without presence of specific bacteria with ferro-oxidizing properties, it is the oxygen (dioxygen - O2 - more precisely) found in the air or in water, which will allow oxidation of iron. No longer able to be contained in the environment in its new form, it will precipitate to appear in this form.
When it’s about a rock, presence of ferric iron (Fe(III)/Fe3+) is noticeable by a rusty coloration or by orange, beige, brown, reddish, purplish or pinkish shades of the rock. But the reverse is not necessarily true. Some of these shades may come from uranium, mercury or other minerals that have undergone various chemical processes.
*An oxic environment contains oxygen in gaseous or dissolved form.
- - -
 Le fer dans les granites
Le fer dans les granites
Le quartz (gris) est principalement formé de silice (SiO2) et ne contient que très rarement du fer. Les feldspaths, qu’il s’agisse d’orthose (rose) ou d’albite (blanche), ne contiennent aussi que rarement du fer. S’ils en sont composés, alors il s’agit alors d’impuretés dont le taux est souvent inférieur à 0,5 %. La muscovite (blanche) ne contient que très rarement du fer. Il existe d’innombrables variétés de tourmalines et celle essentiellement présente dans les granites contient un peu de fer. Sa couleur est alors noire. Mais, vous l’avez vu, la tourmaline est un minéral accessoire dans la composition des granites et elle n’est donc pas toujours présente. La biotite (noir ou brun foncé) contient du fer dans des proportions non négligeables.
Les granites sont majoritairement des roches acides et le fer contenu dans tous ces minéraux l’est essentiellement sous forme de fer ferreux (fer(II)/ion Fe2+), dissout dans la roche.
 Iron in granites
Iron in granites
Quartz (grey) is mainly formed of silica (SiO2) and only very rarely contains iron in the form of oxides. Feldspars, both orthose (pink) and albite (white), also rarely contain iron. If they do, then they are impurities, often less than 0.5%. Muscovite (white) rarely contains iron. There are numberless varieties of tourmaline, and the one mainly found in granites contains some iron. Its color is then black. But, as you have seen, tourmaline is an accessory mineral in the composition of granites and it is not always present. Biotite (black or dark brown) contains iron in significant proportions.
Granites are mainly acidic rocks and the iron in all of these minerals is essentially in the form of ferrous iron (iron(II)/Fe2+ ion), dissolved in the rock.
- - -
 Dégradation des pierres de construction
Dégradation des pierres de construction
Lorsque la roche est extraite pour devenir pierre, le matériau subit un bouleversement important : l’état métastable (variation lente des conditions environnementales) dans lequel elle se trouvait est rompu. La pierre est alors soumise à un milieu en perpétuel changement dont l’amplitude de ses variations peut le rendre très agressif. Et ce phénomène s’est accentué par le rapide développement des polluants.
 Le phénomène de dégradation des pierres est principalement gouverné par les conditions climatiques (pluie, froid, soleil, vent, pollution atmosphérique, …), par la morphologie du bâti (sculptures, façades, corniches, balcons, encadrement de fenêtres, …) et l’exposition (faces Nord, Est, Sud, Ouest vis-à-vis des phénomènes météorologiques, parties basses vis-à-vis de l’influence du sol), mais aussi par la nature de la pierre elle-même (composition minéralogique, structure de porosité).
Le phénomène de dégradation des pierres est principalement gouverné par les conditions climatiques (pluie, froid, soleil, vent, pollution atmosphérique, …), par la morphologie du bâti (sculptures, façades, corniches, balcons, encadrement de fenêtres, …) et l’exposition (faces Nord, Est, Sud, Ouest vis-à-vis des phénomènes météorologiques, parties basses vis-à-vis de l’influence du sol), mais aussi par la nature de la pierre elle-même (composition minéralogique, structure de porosité).
On distingue donc différentes morphologies d’altérations liées aux différents types de conditions environnementales. Et classiquement, ces altérations et dégradations peuvent se regrouper en trois catégories principales : les altérations physiques, qui résultent d’une dissociation des constituants de la pierre mais sans en modifier la composition minéralogique ; les altérations chimiques où les minéraux de la partie superficielle sont transformés par apport ou départ d’éléments ; et les altérations d’origine biologique. La dégradation des pierres sur un bâtiment résulte en général de la combinaison de ces trois processus.
Sans faire la liste de toutes les dégradations que peuvent subir les pierres de construction, vous trouverez en photos quelques unes qui sont assez courantes.
 Degradation of building stones
Degradation of building stones
When rock is extracted to become stone, the material undergoes a major upheaval: the metastable state (slow variation of environmental conditions) in which it was is broken. The stone is then subjected to an environment in perpetual change whose amplitude of its variations can make it very aggressive. And this phenomenon is accentuated by the rapid development of pollutants.
The phenomenon of stone degradation is mainly governed by climatic conditions (rain, cold, sun, wind, atmospheric pollution, ...), by the morphology of the building (sculptures, facades, cornices, balconies, window frames, ...) and exposure (North, East, South, West faces with respect to meteorological phenomena, lower parts with respect to the influence of the ground), but also by the nature of the stone itself (mineralogical composition, porosity structure).
We can therefore distinguish different morphologies of alterations related to the different types of environmental conditions. Traditionally, these alterations and degradations can be grouped into three main categories: physical alterations, which result from a dissociation of the constituents of the stone but without modifying its mineralogical composition; chemical alterations where the minerals of the surface part are transformed by contribution or removal of elements; and alterations of biological origin. The degradation of stones on a building is generally the result of the combination of these three processes.
Without listing all the degradations that building stones can undergo, you will find in the pictures some that are quite common.
- - -
 Porosité et perméabilité
Porosité et perméabilité
La porosité et la perméabilité sont des propriétés connexes de toute roche ou sédiment meuble. Les deux sont liées au nombre, à la taille et aux connexions des espaces vides dans la roche.
Plus précisément, la porosité d'une roche est une mesure de sa capacité à retenir un fluide. La perméabilité est une mesure de la facilité d'écoulement d'un fluide à travers un solide poreux. Une roche peut être extrêmement poreuse, mais si les pores ne sont pas reliés, elle n'aura aucune perméabilité. Une roche, dont les pores non reliés (donc imperméable), altérée, fracturée, pourra en partie laisser circuler un fluide ; on parle alors de perméabilité de fracture.
 Porosity and permeability
Porosity and permeability
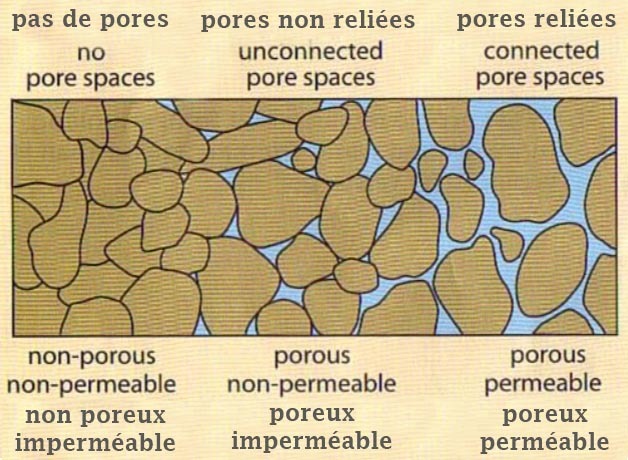 Porosity and permeability are related properties of any rock or loose sediment. Both are related to the number, size, and connections of openings in the rock.
Porosity and permeability are related properties of any rock or loose sediment. Both are related to the number, size, and connections of openings in the rock.
More specifically, porosity of a rock is a measure of its ability to hold a fluid. Permeability is a measure of the ease of flow of a fluid through a porous solid. A rock may be extremely porous, but if the pores are not connected, it will have no permeability.A rock, whose pores are not connected (therefore impermeable) are altered, cracked, can partially let a fluid circulate ; it’s then called fracture permeability.
- - -
 Traitement des granites après extraction
Traitement des granites après extraction
Après son extraction d’une carrière, le granite va souvent subir un trempage des tranches dans une solution à base d’acide chlorhydrique (HCl) et/ou dans une solution à base d’eau oxygénée (H2O2) afin d’éliminer toute matière organique. À l’issue de ce/ces traitement/s la pierre est rincée à l’eau et séchée.
Si certaines roches, dont le granite, ne sont pas très sensibles à l’acide chlorhydrique comme le sont les roches calcaires
(dissolution du carbonate de calcium), sa présence persistante à leur surface peut néanmoins altérer leur porosité, d’où le rinçage.
La porosité des granites est très faible, ils sont donc imperméables.
 Granite processing after extraction
Granite processing after extraction
After extraction from a quarry, granite will often be treated by soaking its slabs in a hydrochloric acid (HCl) and/or hydrogen peroxide (H2O2) solution to remove any organic matter. Following this/these treatment(s) the stone is rinsed with water and dried.
If some rocks, including granite, are not very sensitive to hydrochloric acid as are limestone rocks (dissolution of calcium carbonate), its persistent presence on their surface can nevertheless alter their porosity, which is why rinsing is necessary.
The porosity of granites is very low, they are therefore impermeable.
Références - References
Difference betweeen oxidizing agent and reducing agent
Le tachage par oxydation des granites en façade
Glossaire illustré sur les formes d’altération de la pierre
Porosity and Permeability
Pour valider la cache - Logging requirements
 Aux coordonnées indiquées, vous trouverez le buste de l'ambassadeur Kosa Pan fixé sur un piédestal, lui-même posé sur un socle.
Aux coordonnées indiquées, vous trouverez le buste de l'ambassadeur Kosa Pan fixé sur un piédestal, lui-même posé sur un socle.
Faites face au buste comme sur la photo ci-dessous.
Le buste est en bronze, c’est-à-dire un alliage dont le cuivre est majoritaire. La surface du buste commence à se couvrir d’une patine qui est le résultat de l’oxydation du cuivre par le dioxygène présent dans l’eau ou dans l’air. Au cours des prochaines années, voire des dizaines d’années, cette patine va prendre une teinte de plus en plus sombre. Différents éléments (chlorures, dioxyde de soufre) présents dans l’atmosphère vont provoquer d’autres réactions (qui ont déjà débuté) et la patine va aborder une teinte verte. Avec un lessivage de cette patine par les eaux de pluie, il est possible qu’une petite surface du granite proche du buste puisse alors arborer teinte verdâtre. Dans ce cas, veuillez ne pas en tenir compte.

 At the specified coordinates, you will find the bust of ambassador Kosa Pan fixed on a pedestal, which is itself placed on a base.
At the specified coordinates, you will find the bust of ambassador Kosa Pan fixed on a pedestal, which is itself placed on a base.
Face the bust as shown in the picture.
The bust is made of bronze, an alloy in which copper is the major component. The surface of the bust is beginning to be covered with a patina resulting from the oxidation of copper by the oxygen present in the water or in the air. Over the next few years, or even decades, this patina will take on an increasingly darker shade. Other elements (chlorides, sulfur dioxide) present in the atmosphere will induce other reactions (which have already started) and the patina will take on a green shade. With leaching of this patina by rainwater, it's possible that a small area of granite close to the bust may have a greenish shade. In this case, please do not take this into account.
- - -
 Travail à effectuer
Travail à effectuer
- Face au buste statue, décrivez ce que vous constatez de particulier à la surface du granite.
- En faisant le tour de l’ensemble, voyez-vous une dégradation similaire sur une autre face du socle ou du piédestal ?
- Quelle est votre hypothèse précise à propos des processus qui ont abouti à l’apparition de la dégradation ?
- Compte-tenu de la/les localisation/s de la dégradation, peut-on penser (tout en le justifiant,) que l’orientation (N, S, E, O, NO, NE, etc.) de l’ensemble l’ait favorisée ?
- Une photo de vous, ou d’un objet caractéristique vous appartenant, prise dans les environs immédiats (pas de photo « d’archive » svp) est à joindre soit en commentaire, soit avec vos réponses. Conformément aux directives mises à jour par GC HQ et publiées en juin 2019, des photos peuvent être exigées pour la validation d'une earthcache.
Marquez cette cache « Trouvée » et envoyez-nous vos propositions de réponses, en précisant bien le nom de la cache, soit via notre profil, soit via la messagerie geocaching.com (centre de messagerie) et nous vous répondrons en cas de problème. « Trouvée » sans réponses sera supprimée.
 Homework
Homework
- Facing the buste, describe what you see special about the surface of the granite.
- Walking around the entire statue, do you see a similar degradation on another face of the base or pedestal?
- What is your specific hypothesis about the processes that led to the appearance of this degradation?
- Considering the location(s) of the degradation, do you think (with justification) that the orientation (N, S, E, W, NW, NE, etc.) of the structure favored it?
- A picture of you, your GPS/cellphone or something else personal taken in the immediate aera (no "stock" photos please) is to be attached either as a comment or with your answers. In accordance with updated GC HQ guidelines published in June 2019, photos may be required for validation of an earthcache.
Log this cache "Found it", and send us your answers, don't forget to mention the name of the cache, via our profile or via geocaching.com (Message Center) and we will contact you in case of any problemes. "Found it" without the anwers will be deleted.