Veryac'h
Ocre ferreuse - Iron ochre
 La presqu’île de Crozon offre un rivage découpé dans un mille-feuilles de roches sédimentaires, d’âge paléozoïque.
La presqu’île de Crozon offre un rivage découpé dans un mille-feuilles de roches sédimentaires, d’âge paléozoïque.
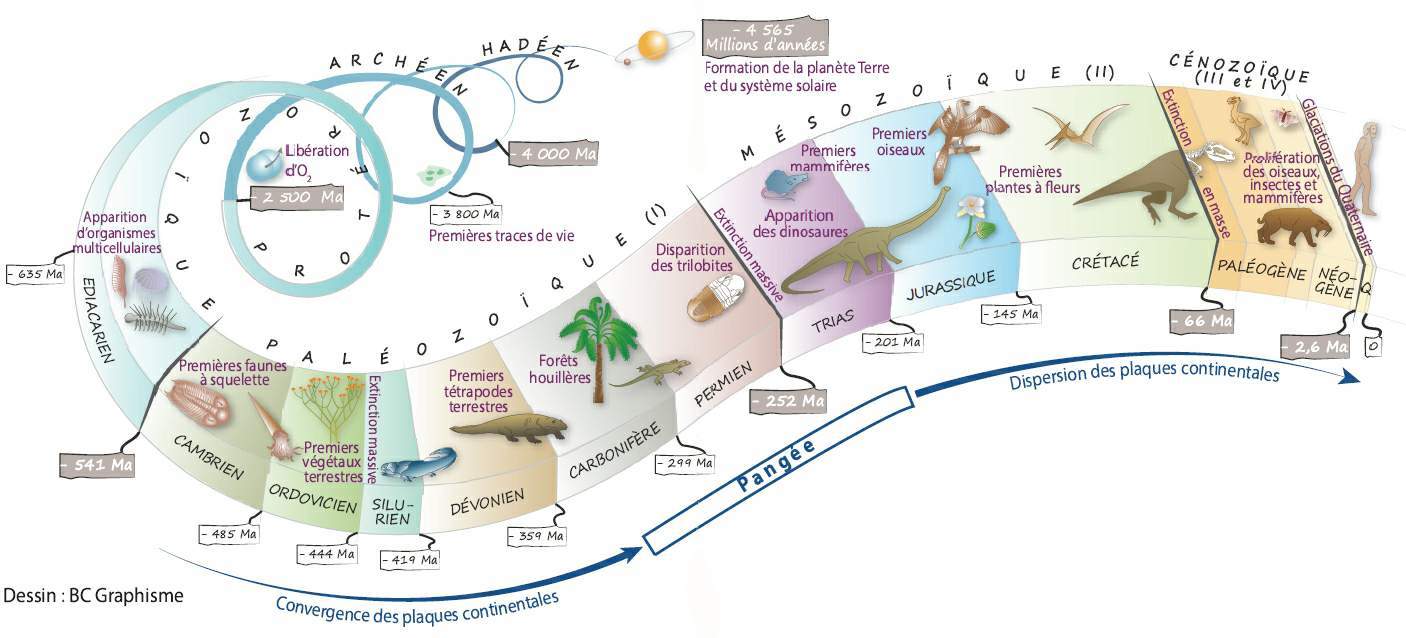
C’est en effet à partir de -475 millions d’années que s’est formé l’essentiel du sous-sol. À cette époque, la Bretagne était située sous la mer, près du pôle Sud, en bordure d’un méga-continent appelé Gondwana.

Les particules de sable et de vase transportées du continent vers la mer s’y sont déposées en couches successives. Compactées au fil du temps, elles se sont transformées en grès et en argilites. Quelques animaux marins, ainsi que les traces de leurs activités, ont en même temps été fossilisés.
Cette sédimentation marine, perturbée en presqu’île de Crozon par une activité volcanique (-448 millions d'années), s’est poursuivie sur près de 150 millions d'années, pendant la lente dérive du Gondwana vers le Nord. Près de 3 500 mètres d’épaisseur de sédiments se sont ainsi accumulés, en enregistrant des environnements marins périglaciaires (-444 millions d'année) puis tropicaux (-385 millions d'années).
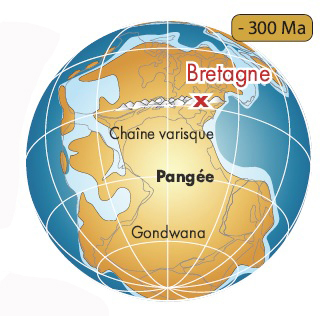
Vers -320 millions d'années, la collision entre les plaques Gondwana et Laurussia, lors de la constitution de la Pangée, a entraîné la formation d’une immense chaîne de montagnes (la chaîne varisque ou hercynienne) dont les sommets pouvaient atteindre 4 000 mètres d’altitude en Bretagne.
Soumises à d’énormes pressions tectoniques, les roches de la future presqu’île se sont plissées et facturées. Tout en perdant leur horizontalité initiale, les couches sédimentaires se sont transformées : les grès ont évolué en quartzites et les argiles en schistes.
Depuis lors émergée, cette imposante chaîne de montagnes a été érodée, puis à nouveau fracturée lors de l’ouverture de l’océan Atlantique (-180 millions d'années)
Les fluctuations du niveau marin, dues à l’alternance d’épisodes glaciaires et tempérés au Quaternaire (de -2.6 millions d'années à nos jours) ont enfin dessiné le trait de côte de cet ancien massif (le Massif armoricain), dont les plus hautes collines avoisinent aujourd’hui les 400 mètres d’altitude.
👉 Histoire géologique de la presqu'île de Crozon en dessins.
Sources : https://www.reservepresquiledecrozon.bzh
 Crozon Peninsula boasts a shoreline carved out of many strata of sedimentary rock dating back to the Paleozoic Era.
Crozon Peninsula boasts a shoreline carved out of many strata of sedimentary rock dating back to the Paleozoic Era.
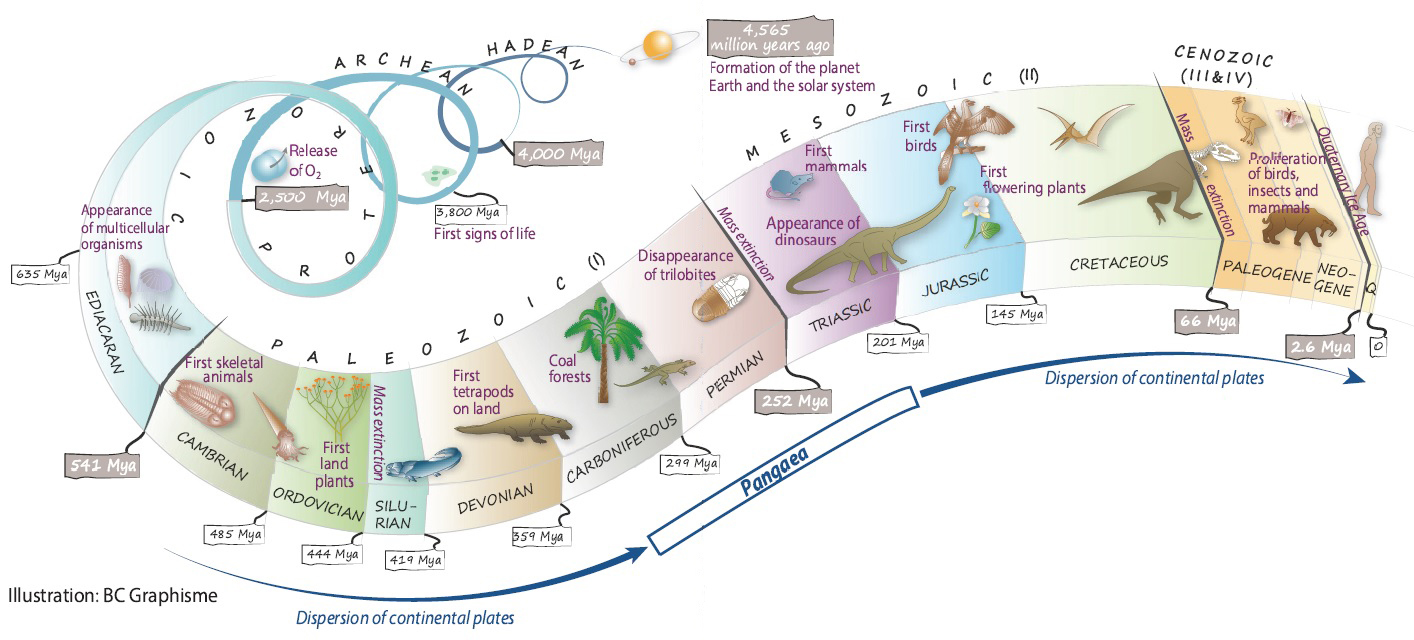
In fact, most of its subsoil was formed some 475 million years ago (mya). At that time, Brittany was under water, close to the South Pole, at the edge of a supercontinent called Gondwana.

Particles of sand and mud carried from the continent out to the sea were deposited there in successive layers. Compacted over time, they gradually transformed into sandstone and mudstone. Some sea animals along with traces of their activities, were fossilized at the same time.
This marine sedimentation, that was disrupted by volcanic activity on Crozon Peninsula (448 mya), continued over the course of nearly 150 million years (myr), during Gondwana’s slow drift northwards. Nearly 3,500 meters of sediments accumulated in depth, where both periglacial and then tropical marine environments were recorded (444 and 385 mya, respectively).
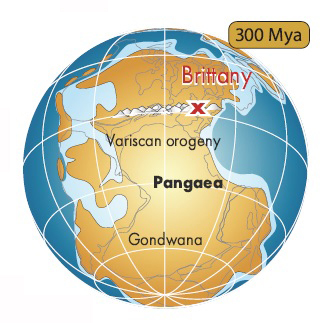
Around 320 mya, the collision of the Gondwana and Laurussia plates, during the assembly of Pangea, led to the formation of an immense mountain range (the Variscan or Hercynian orogeny) whose peaks stood as high as elevation of 4,000 meters in Brittany.
Subjected to tremendous tectonic pressure, the rocks of the future peninsula folded and farctured. Whilst losing their initial horizontality, the sedimentary layers were transformed : the sandstone evolved into quartzite and the mudstone into shale.
After emerging, the imposing mountain range eroded and then fractured again at the time of opening of the Atlantic Ocean (180 mya).
Fluctuations in the sea level, caused by the alternating glacial and tempered episodes of the Quaternary period (from 2.6 mya to the present day), finally drawing the coastline of the ancient Armorican mountain range, whose tallest hillsides now rise to altitudes of around 400 meters.
👉 Geologic timeline illustrations of Crozon peninsula (only in french).
Sources : https://www.reservepresquiledecrozon.bzh
Veryac'h

 La coupe du Veryac’h est une référence mondiale pour l’Ordovicien (-488 à -443 Ma) et la base du Silurien (-428 à -419 Ma). Cette coupe permet d’observer presque en continu une succession de plusieurs formations géologiques, de l’Arenig (Ordovicien inférieur) au Ludlow (Silurien supérieur), soit plus de 50 millions d’années d’archives sédimentaires marines et paléontologiques.
La coupe du Veryac’h est une référence mondiale pour l’Ordovicien (-488 à -443 Ma) et la base du Silurien (-428 à -419 Ma). Cette coupe permet d’observer presque en continu une succession de plusieurs formations géologiques, de l’Arenig (Ordovicien inférieur) au Ludlow (Silurien supérieur), soit plus de 50 millions d’années d’archives sédimentaires marines et paléontologiques.
En complément des 7 caches existantes, nous vous proposons de découvrir quelques curiosités géologiques visibles sur ce trait de côte.
Au travers de cette 6ème cache, vous pourrez découvrir une petite source ainsi que la formation d'ocre ferreuse.
Pour traiter cette cache, devrez être en possession de papier réactif ou de tout autre système permettant de mesurer le pH.
 The Veryac'h cross-section is a world reference for the Ordovician (488 to 443 mya) and the base of the Silurian (428 to 419 mya). This cross-section allows to observe continuously the stacking of several geological formations, from the Arenig (Lower Ordovician) to the Ludlow (Upper Silurian), that is to say more than 50 million years of marine sedimentary and paleontological archives.
The Veryac'h cross-section is a world reference for the Ordovician (488 to 443 mya) and the base of the Silurian (428 to 419 mya). This cross-section allows to observe continuously the stacking of several geological formations, from the Arenig (Lower Ordovician) to the Ludlow (Upper Silurian), that is to say more than 50 million years of marine sedimentary and paleontological archives.
In addition to the 7 existing caches, we propose to discover some geological curiosities visible on this coastline.
Through this 6th cache, you can discover a small spring with iron ochre in formation.
To process this cache, will need to be equipped with reagent paper or any other system for measuring pH.
Quelques concepts - Few concepts
 Altération des roches
Altération des roches
 L’altération, aussi appelée météorisation, correspond à la décomposition des roches et des minéraux à la surface et sous la surface de la Terre par l'action de processus physiques, chimiques et biochimiques. Il s'agit essentiellement de la réponse des matériaux terrestres aux faibles pressions, aux basses températures et à la présence d'air et d'eau qui caractérisent l'environnement proche de la surface, mais qui n'étaient pas typiques de l'environnement de formation.
L’altération, aussi appelée météorisation, correspond à la décomposition des roches et des minéraux à la surface et sous la surface de la Terre par l'action de processus physiques, chimiques et biochimiques. Il s'agit essentiellement de la réponse des matériaux terrestres aux faibles pressions, aux basses températures et à la présence d'air et d'eau qui caractérisent l'environnement proche de la surface, mais qui n'étaient pas typiques de l'environnement de formation.
 Rock weathering
Rock weathering
Weathering is the breakdown of rocks and minerals at and below the Earth’s surface by the action of physical, chemical and biochemical processes. Essentially it is the response of Earth materials to the low pressures, low temperatures, and presence of air and water that characterize the near-surface environment, but which were not typical of the environment of formation.
- - -
 Ion, anion et cation
Ion, anion et cation
Dans un atome neutre, le nombre de protons = le nombre d'électrons. Un ion est un atome, ou un groupe d'atomes, ayant perdu ou gagné un ou plusieurs électrons.
Un anion est un atome (ou une molécule) qui a gagné un ou plusieurs électrons. Comme l'électron est chargé négativement, l'anion porte une charge négative. Il s’agit donc d’un ion négatif.

À l'inverse, un cation est un atome (ou une molécule) qui a perdu un ou plusieurs électrons. La charge électrique globale du cation est donc positive. Il s’agit donc d’un ion positif.
Les ions sont notés en tenant compte de la différence entre le nombre de protons et le nombre d'électrons. Dans la version « simple », on écrira Xn+ et Xn- pour respectivement, un ion qui porte une charge positive (cation) car plus de protons que d’électrons et un ion qui porte une charge négative (anion) car moins de protons que d’électron. Ex : Na+ ou OH- (on n’écrit pas n=1).
 Ion, anion and cation
Ion, anion and cation
In a neutral atom, the number of protons = the number of electrons. An ion is an atom, or a group of atoms, that has lost or gained one or more electrons.
An anion is an atom (or a molecule) that has gained one or more electrons. As the electron is negatively charged, the anion has a negative charge. It is therefore a negative ion.
Conversely, a cation is an atom (or molecule) that has lost one or more electrons. The overall electrical charge of the cation is therefore positive. It is therefore a positive ion.
Ions are noted by taking into account the difference between the number of protons and the number of electrons. In the "basic" version, we write Xn+ and Xn- for respectively, an ion that carries a positive charge (cation) because it has more protons than electrons and an ion that carries a negative charge (anion) because it has less protons than electrons. Ex : Na+ or OH- (we do not write n=1).
- - -
 Oxydation, réduction, nombre d’oxydation, oxydant, réducteur et … patati et patata !
Oxydation, réduction, nombre d’oxydation, oxydant, réducteur et … patati et patata !
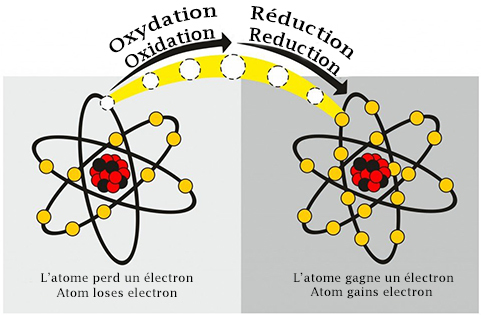 L'oxydation est un phénomène courant ; une pomme brunie ou un clou rouillé sont deux exemples courants de réactions d'oxydation. L'oxydation ne signifie pas qu'un atome d'oxygène est ajouté au composé. Il s'agit plutôt d'une réaction chimique qui implique la perte d'électrons.
L'oxydation est un phénomène courant ; une pomme brunie ou un clou rouillé sont deux exemples courants de réactions d'oxydation. L'oxydation ne signifie pas qu'un atome d'oxygène est ajouté au composé. Il s'agit plutôt d'une réaction chimique qui implique la perte d'électrons.
Cet électron perdu ne se promène pas sans but dans l'univers ; il est pris en charge par un autre atome. Lorsqu'un atome accepte un électron, il s'agit d'une réaction de réduction. L'oxydation et la réduction vont de pair et sont appelées conjointement des réactions d'oxydoréduction (souvent appelées redox).
Le nombre d'oxydation, également appelé état d'oxydation, est le nombre total d'électrons qu'un atome gagne ou perd afin de former une liaison chimique avec un autre atome.
Les atomes neutres isolés (corps à l’état élémentaire) ont par définition un nombre d’oxydation nul. Si un atome donne (perd) un électron, on dit qu'il a un nombre d'oxydation (n.o.) égal à un +I ; s'il en donne deux, n.o. = +II, etc. Réciproquement, si un atome accepte (reçoit) un électron, son nombre d'oxydation devient -I ; s'il en accepte deux, n.o. = −II, etc.
Le nombre d’oxydation maximal est +VII et le nombre minimal est –II.
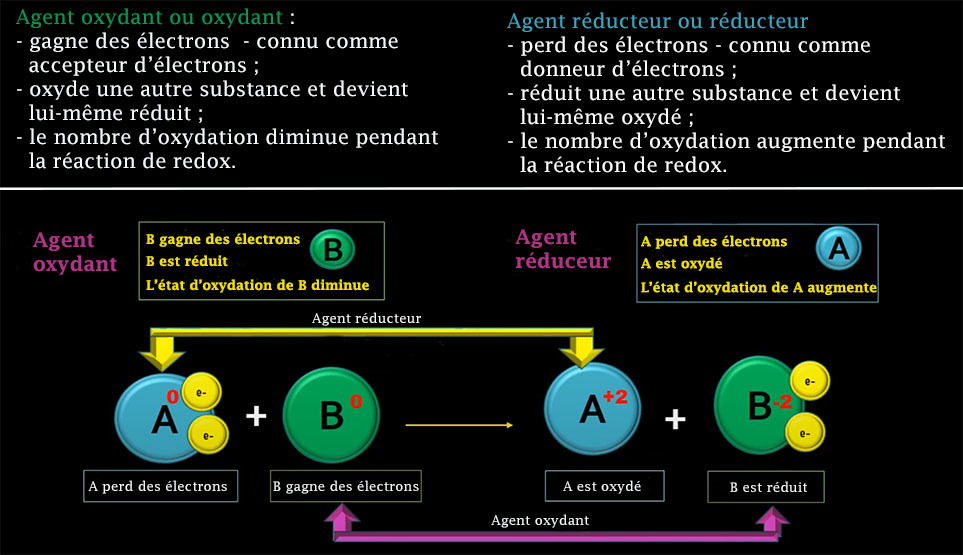
Un oxydant, ou agent oxydant ou agent d'oxydation, est un corps simple, un composé ou un ion qui reçoit au moins un électron d'une autre espèce chimique lors d'une réaction d'oxydoréduction. L'oxydant ayant accepté au moins un électron au cours de cette réaction est dit réduit, tandis que l'espèce chimique qui a cédé au moins un électron est dite oxydée. Un oxydant est généralement proche de son état d'oxydation le plus élevé et se comporte par conséquent comme un accepteur d'électron.
Un réducteur est un corps simple, un composé ou un ion qui cède au moins un électron à une autre espèce chimique lors d'une réaction d'oxydoréduction. Le réducteur ayant perdu au moins un électron au cours de cette réaction est dit oxydé, tandis que l'espèce chimique qui a reçu au moins un électron est dite réduite. Un réducteur est généralement proche de son état d'oxydation le plus faible et se comporte par conséquent comme un donneur d'électron.
Les métaux sont généralement considérés comme des éléments qui peuvent facilement perdre des électrons, ils sont donc connus pour être facilement oxydés.
 Oxidation, reduction, oxidation number, oxydant, reductant and do on and so forth
Oxidation, reduction, oxidation number, oxydant, reductant and do on and so forth
Oxidation is a common phenomenon; a browned apple or a rusty nail are both common examples of oxidation reactions. Oxidation does not mean that an oxygen atom is added to the compound. Instead, it is a chemical reaction that involves the loss of electrons.
This lost electron does not wander around in the universe aimlessly; it is taken up by another atom. When one atom accepts an electron, it is called a reduction reaction. Oxidation and reduction go hand-in-hand and are jointly referred to as redox reactions.
The oxidation number, also called the oxidation state, is the total number of electrons that an atom gains or loses in order to form a chemical bond with another atom.
Isolated neutral atoms (elementary material) have by definition an oxidation number of zero. If an atom gives (loses) one electron, it is said to have an oxidation number ( o.n.) equal to +I; if it gives two, o.n. = +II, etc. Reversely, if an atom accepts (receives) an electron, its oxidation number becomes -I; if it accepts two, n.o. = -II, etc.
The maximum oxidation number is +VII and the minimum is -II.
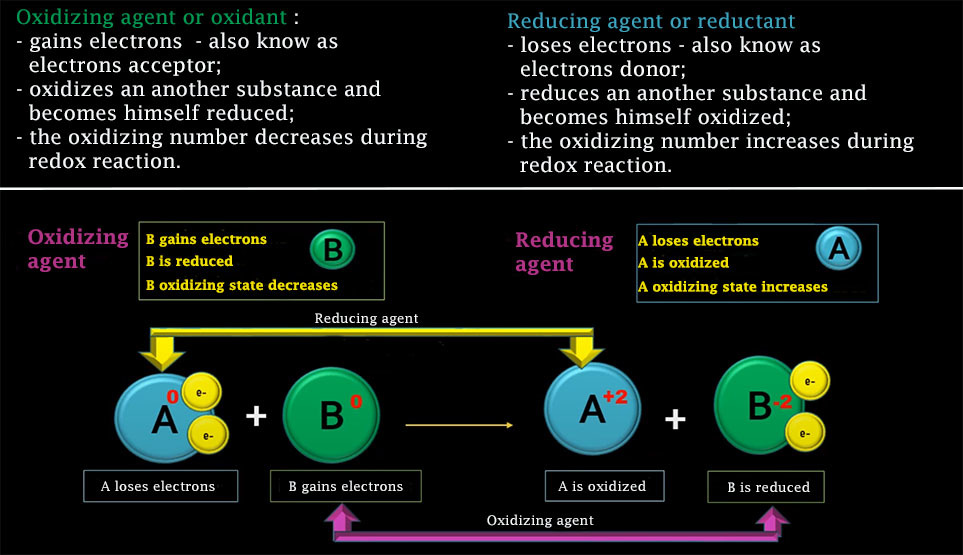
An oxidizing agent, or oxidant, is a simple body, compound or ion that receives at least one electron from another chemical species during a redox reaction. The oxidant agent that has accepted at least one electron during this reaction is said to be reduced, while the chemical species that has given up at least one electron is said to be oxidized. An oxidant agnet is usually close to its highest oxidation state and therefore behaves as an electron acceptor.
A reducing agent, or reductant, is a simple body, compound or ion that gives up at least one electron to another chemical species in a redox reaction. The reductant that has lost at least one electron during this reaction is said to be oxidized, while the chemical species that has received at least one electron is said to be reduced. A reducing agent is generally close to its weakest oxidation state and therefore behaves like an electron donor.
Metals are generally considered to be elements that can easily lose electrons, so they are known to be easily oxidized.
- - -
 Le fer
Le fer
Le fer, un métal de symbole chimique Fe, est l’un des éléments les plus abondants de la croûte terrestre. Il existe sous plusieurs formes de degré d'oxydation allant de -II à +VII ; cependant, il est principalement présent sous forme +II ou +III.
Le fer, à l’état naturel, existe principalement sous deux formes oxydées :
- l’oxyde de fer(II) appelé aussi « fer ferreux », noté Fe(II) mais aussi Fe2+ pour l’ion ferreux. Il est souvent présent sous forme soluble (comme le sucre ou le sel dans l’eau) dans les roches et l’acidité de la roche favorise sa solubilité.
- l’oxyde de fer(III) appelé aussi « fer ferrique » ; noté Fe(III) mais aussi Fe3+pour l’ion ferrique. Il est très rarement présent sous forme soluble dans les roches.
Fe(II) et Fe(III) n'existent pas seuls, mais au sein d'une molécule : Fe3O4, Fe2CO3, FeS2 ...
On peut aussi le trouver sous forme métallique - Fe(0) - qui est le résultat d’un fer transformé par les activités humaines à partir de minerais de fer.
 Iron
Iron
Iron, chemical symbol Fe, is one of the most abundant elements in the earth's crust. It exists in several forms of oxidation degree going from -II to +VII; however, it is mainly present in the +II or +III form.
Iron, in its natural state, exists mainly in two oxidized forms:
- iron(II) oxide also called "ferrous iron", noted Fe(II) but also Fe2+ for ferrous ion. It is often present in soluble form (like sugar or salt in water) in rocks and the acidity of the rock favors its solubility.
- Iron(III) oxide also called "ferric iron"; noted Fe(III) but also Fe3+ for ferric ion. It is very rarely found in soluble form in rocks.
Fe(II) and Fe(III) do not exist alone, but within a molecule: Fe3O4, Fe2CO3, FeS2 ...
It can also be found in metallic form - Fe(0) – which is the result of iron transformed by human activities from iron ores.
- - -
 Oxique, anoxique, aérobie, anaérobie, aérophile, micro-aérophile
Oxique, anoxique, aérobie, anaérobie, aérophile, micro-aérophile
Un milieu est oxique s’il contient de l’oxygène sous forme gazeuse ou sous forme dissoute.
Un milieu anoxique est un milieu dépourvu d’oxygène ou qui a perdu tout l’oxygène.
Le mot aérobie peut être employé dans deux contextes. Un milieu ou une condition aérobie est un milieu ou une condition qui nécessite la présence d’oxygène (du dioxygène – O2 – plus précisément). Un organisme aérobie est un organisme qui a besoin de dioxygène pour vivre.
À l’inverse, un organisme anaérobie n’a pas besoin de dioxygène pour vivre, et un milieu ou une condition anaérobie est un milieu ou une condition qui ne nécessite pas la présence de dioxygène.
Un organisme aérophile vit dans un milieu fortement ventée, car il a besoin d’air atmosphérique. Le mot aérophile s’applique le plus souvent aux bactéries aérobies. Un aérophile est dépendant de l’oxygène libre ou de l’air. La croissance d’un organisme micro-aérophile (ou microaérophile) est optimale dans un milieu où la concentration dioxygène est inférieure à la concentration atmosphérique (actuellement de l’ordre de 21 %).
 Oxic, anoxic, aerobic, anaerobic, aerophile, micro-aerophile
Oxic, anoxic, aerobic, anaerobic, aerophile, micro-aerophile
An oxic environment contains oxygen in gaseous or dissolved form.
An anoxic environment is an oxygen-free environment or one that has lost all oxygen.
The word aerobic can be used in two contexts. An aerobic environment or condition is one that requires the presence of oxygen (dioxygen - O2 - to be precise). An aerobic organism is one that requires oxygen to live.
By contrast, an anaerobic organism does not require dioxygen to live, and an anaerobic environment or condition is one that does not require the presence of dioxygen.
An aerophile organism lives in a highly windy environment because it requires atmospheric air. The word aerophile is most often applied to aerobic bacteria. An aerophile is dependent on free oxygen or air. The growth of a micro-aerophile (or microaerophile) organism is optimal in an environment where oxygen concentration is lower than in the atmosphere (wiich is currently about 21%).
- - -
 Bactéries
Bactéries
Les bactéries sont des organismes vivants qui ne sont constitués que d’une seule cellule : on dit qu’ils sont unicellulaires. Dotés d’une membrane cellulaire et d’un matériel génétique (ADN), les bactéries sont capables d’assumer les fonctions élémentaires propres au vivant : se reproduire, transmettre l’information génétique, mais aussi tirer matière et énergie de l’environnement. Elles possèdent une certaine autonomie et un métabolisme propre.
 Bacteria
Bacteria
Bacteria are living organisms made up of only one cell: they are said to be unicellular. With a cell membrane and genetic material (DNA), bacteria are able to perform the basic functions of living organisms: reproduce, transmit genetic information, but also draw matter and energy from the environment. They have a degree of self-sufficiency and a specific metabolism.
- - -
 Acidité et basicité
Acidité et basicité
L'acidité et la basicité sont définies par le potentiel d'hydrogène noté pH. Le potentiel d’hydrogène est une mesure de l'activité chimique des protons ou ions hydrogène en solution. Dans un milieu aqueux et à la température 25 °C, si celui-ci est compris entre 0 et 7 (7 exclu), la solution est acide, s'il est égal à 7, elle est alors neutre, et de 7 à 14 (7 exclu), elle sera basique. Diverses méthodes permettent de mesurer le pH : papier réactif, pH-mètre, papier tournesol, etc.
 Si un pH-mètre peut définir de façon précise la valeur du pH (au 1/10 voire 1/100), le papier réactif (ou une bandelette réactive) ne permettra le plus souvent que d’obtenir 14 valeurs significative du pH (1 à 14). Trempez et ressortez le papier ou la bandelette dans la solution, attendez un instant que le papier vire (change de couleur) et comparez-la avec l’échelle de couleur graduée fournie avec le papier.
Si un pH-mètre peut définir de façon précise la valeur du pH (au 1/10 voire 1/100), le papier réactif (ou une bandelette réactive) ne permettra le plus souvent que d’obtenir 14 valeurs significative du pH (1 à 14). Trempez et ressortez le papier ou la bandelette dans la solution, attendez un instant que le papier vire (change de couleur) et comparez-la avec l’échelle de couleur graduée fournie avec le papier.
 Acidity and basicity
Acidity and basicity
Acidity and basicity are defined by the hydrogen potential (pH). Hydrogen potential is a measure of the chemical activity of protons or hydrogen ions in solution. In an aqueous medium at a temperature of 25°C, if the pH is between 0 and 7 (7 excluded), the solution is acidic; if it is equal to 7, it is neutral; and from 7 to 14 (7 excluded), it is basic. Various methods are used to measure pH: reagent paper, pH meter, litmus paper, etc.
While a pH meter can precisely define the pH value (to 1/10 or even 1/100), reagent paper (or a test strip) will usually only give 14 significant pH values (1 to 14). Dip the paper or strip in the solution, wait a moment for the paper to turn (change color) and compare it with the graduated color scale supplied with the paper.
- - -
 Oxydation et réduction du fer
Oxydation et réduction du fer
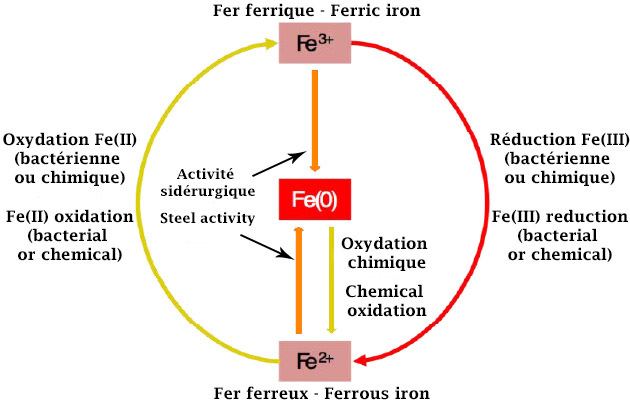 L’oxydation ou la réduction du fer peut s’opérer de deux manières : chimiquement de façon naturelle ou biochimiquement, et les deux peuvent être associées. Ce sont les conditions initiales ainsi que l’environnement ou le milieu qui vont déterminer le type de réaction dont le fer va faire l’objet.
L’oxydation ou la réduction du fer peut s’opérer de deux manières : chimiquement de façon naturelle ou biochimiquement, et les deux peuvent être associées. Ce sont les conditions initiales ainsi que l’environnement ou le milieu qui vont déterminer le type de réaction dont le fer va faire l’objet.
Lorsqu’il est sous forme dissoute (état ionique Fe2+) et dans un environnement oxique neutre et dépourvu d’organismes vivants, le fer peut être oxydé pour prendre la forme d‘un oxyde ferrique solide (état ionique Fe3+). Si l’environnement oxique est acide, alors le fer dissout (état ionique Fe2+) pourra être oxydé pour prendre la forme d’un oxyde ferrique également dissout (état ionique 3+).
La présence d’organismes vivants, dont les bactéries, peut provoquer des réactions d’oxydoréduction qui n’auraient pas eu lieu sans la présence de ces organismes.
 Iron oxidation and reduction
Iron oxidation and reduction
Oxidation or reduction of iron can occur in two modes: chemically in a natural way or biochemically, and the two can be combined. The initial conditions as well as the environment or the background will determine the type of reaction that iron will undergo.
When it is in dissolved form (ionic state Fe2+) and in a neutral oxic environment devoid of living organisms, iron can be oxidized to a solid iron oxide (ionic state Fe3+). If the oxic environment is acidic, then the dissolved iron (ionic state Fe2+) can be oxidized to take the form of a ferric oxide also dissolved (ionic state Fe3+).
The presence of living organisms, including bacteria, can trigger redox reactions that would not have occurred without the presence of these organisms.
- - -
 Les bactéries ferro-oxydantes
Les bactéries ferro-oxydantes
Elles vont mettre à profit l’énergie issue de la réaction d’oxydation du fer dissout dans le milieu pour évoluer. Différents groupes de bactéries, propres à un milieu particulier, peuvent être à l’origine de l’oxydation du fer :
• les bactéries acidophiles, oxydants aérobie : elles peuvent évoluer dans un milieu acide (pH<5) mais nécessitent la présence d’oxygène ;
• les bactéries neutrophiles, oxydants aérobie : elles évoluent dans un milieu neutre (autour de pH=7) et nécessite la présence d’oxygène. Deux catégories sont remarquables : les neutrophiles ferro-oxydants d’eau douce et les neutrophiles ferro-oxydants d’eau de mer ;
• les bactéries photo-oxydants anaérobie : encore appelées bactéries phototrophes. Elles évoluent en milieu neutre (autour de pH=7) et ne nécessite pas la présence d’oxygène. Pour faire court, elles réalisent la photosynthèse aquatique.
• les bactéries neutrophiles anaérobies nitrate-dépendants : elles évoluent en milieu neutre (autour de pH=7), ne nécessitent pas la présence d’oxygène. Pour faire court encore une fois, il s’agit de bactéries qui dépendent de nitrates (NO3-), qu’elles vont réduire. Le produit de cette réduction permettra d’oxyder le fer par ces mêmes bactéries.
Sur le schéma, l’action des différents groupes de bactéries ferro-oxydantes est matérialisée par les flèches noires.
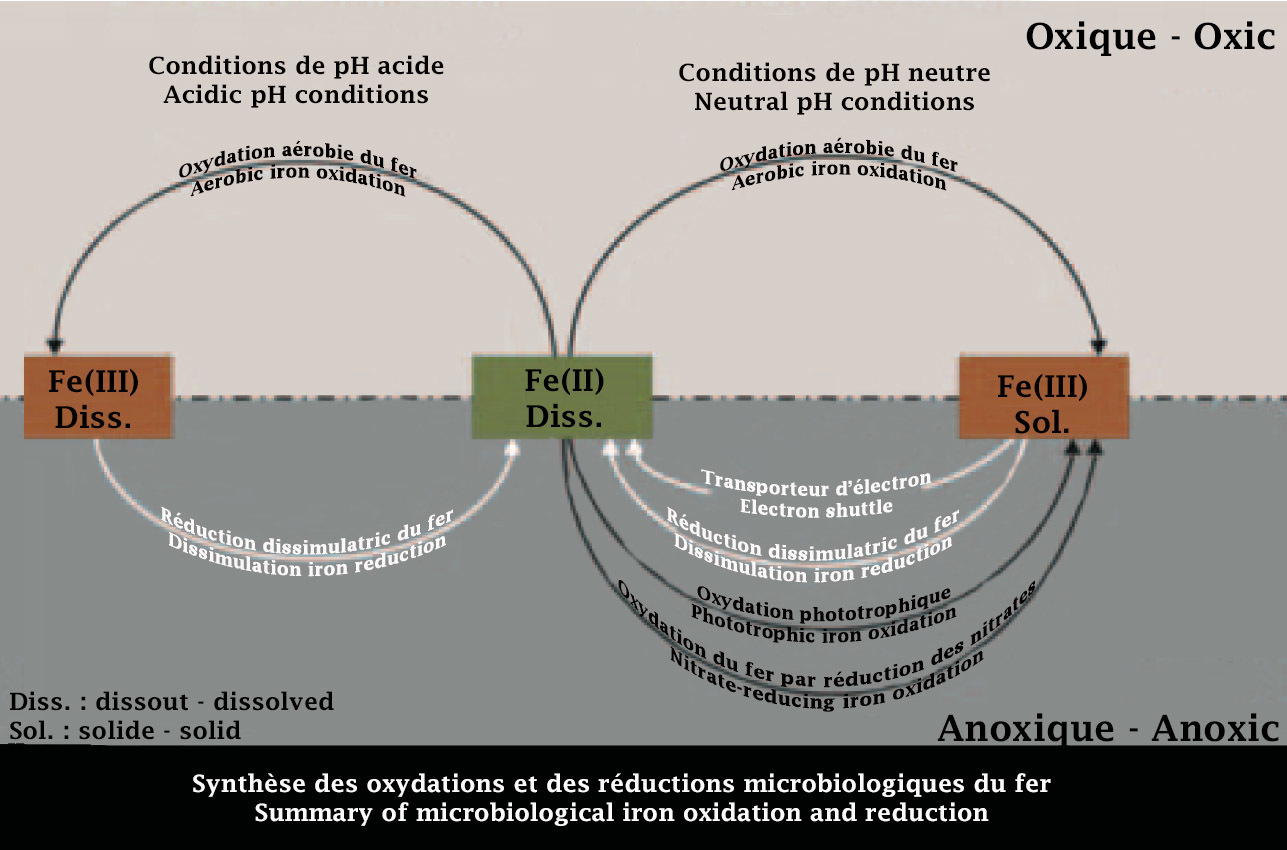
 Ferro-oxidizing bacteria
Ferro-oxidizing bacteria
They will use the energy from the oxidation reaction of iron dissolved in the environment to grow. Different groups of bacteria, specific to a particular environment, can be at the origin of iron oxidation:
• acidophilic bacteria, aerobic oxidizers: they can grow in an acidic environment (pH< 5 ) but require the presence of oxygen;
• neutrophils, aerobic oxidizers: they grow in a neutral environment (around pH=7) and require the presence of oxygen. Two categories are remarkable: freshwater ferro-oxidizing neutrophils and seawater ferro-oxidizing neutrophils;
• anaerobic photo-oxidant bacteria: also known as phototrophs. They grow in a neutral environment (around pH=7) and do not require the presence of oxygen. In short, they carry out aquatic photosynthesis;
• nitrate-dependent anaerobic neutrophils: they grow in a neutral environment (around pH=7), do not require the presence of oxygen. To make a long story short, these bacteria depend on nitrates (NO3-), which they will reduce. The product of this reduction will allow the iron to be oxidized by these same bacteria.
The action of the different groups of ferro-oxidizing bacteria is shown by black arrows in the diagram.
- - -
 Mais d’où provient le fer dissous dans l’eau ?
Mais d’où provient le fer dissous dans l’eau ?
Si du fer, dissout dans l’eau, est oxydé par de le dioxygène et/ou par l’activité de bactéries peu après son écoulement hors de terre, d’où provient-il exactement ?
Du fer, sous une forme que peuvent prendre les différents types d’oxydes ferriques (état ionique Fe3+) peut être naturellement présent dans les roches sous terre ou dans des sédiments. Ce milieu ou cet environnement est généralement pauvre ou sans oxygène, donc anoxique. Cependant, une vie y est possible. Ce sont des bactéries ferri-réductrices qui vont réduire le fer vers son état ionique Fe2+ pour être dissout au niveau des roches ou des sédiments. L’eau (anoxique elle aussi), qui pourrait circuler, sera le vecteur de diffusion de cette nouvelle forme du fer. L’ensemble des mécanismes de transformation du fer ferrique (ion Fe3+) en fer ferreux (ion Fe2+) par les bactéries ferri-réductrices est qualifié de respiration anaérobie ou encore de réduction dissimulatrice des métaux (« des » car le manganèse est aussi concerné) ou Dissimilatory Metal Reduction – DMR – en anglais.
Mais c’est sans compter sur les bactéries sulfato-réductrices (BSR), qui indirectement par leur activité, peuvent participer à la réduction du fer ferrique. En effet, les BSR convertissent en énergie cellulaire de l’énergie produite conjointement par des réactions de réduction de sulfates (SO4) solubles et par des réactions d‘oxydation de matière organique. Les sulfures, produits par la réduction des sulfates par les BSR, pourront provoquer à leur tour des réactions de réduction des oxydes ferriques contenus dans les roches ou plus particulièrement dans des sédiments non encore transformées en roches (dures).
 But where does the dissolved iron in water come from?
But where does the dissolved iron in water come from?
If iron, dissolved in water, is oxidized by oxygen and/or by the activity of bacteria shortly after it has left the ground, where exactly does it come from?
Iron, in a form that various types of ferric iron (Fe3+ ionic state) can take, is naturally present in the rocks underground. This area or environment is generally poor or without oxygen, therefore anoxic. However, life is possible. It’s the iron-reducing bacteria that will reduce iron to its ionic state Fe2+ to be dissolved in the rocks. The water (also anoxic), which could circulate underground, will be the diffusion vector of this new form of iron. The whole mechanism of iron transformation from ferric iron (Fe3+ ion) to ferrous iron (Fe2+ ion) by iron-reducing bacteria is called anaerobic respiration or Dissimilatory Metal Reduction – DMR – also applicable to manganese.
But this is without considering the sulfate-reducing bacteria (SRB), which indirectly by their activity, can participate in the reduction of ferric iron. Indeed, the SRB convert into cellular energy the energy produced jointly by reactions of reduction of soluble sulfates (SO4) and by reactions of oxidation of organic matter. The sulphides, produced by the reduction of sulphates by the SRB, will be able to trigger in their turn reduction reactions of the ferric oxides present in rocks or more particularly in the sediments not yet transformed into (hard) rocks.
- - -
 Ocre ferreuse
Ocre ferreuse
L’ocre ferreuse, aussi appelée rouille des marais, est un dépôt boueux rougeâtre/orangé qui résulte d’une activité chimique ou d’une activité biologique ou alors des deux. Cette boue contient de l’hydroxyde de fer, un oxyde de fer hydraté appelé ferrihydrite, résultat d'une hydrolyse et de l’oxydation de fer ferreux (Fe2+).
 Un certain nombre de conditions doivent être réunies pour que l’ocre ferreuse se forme. Il faut d’abord une eau stagnante ou qui coule très lentement. L’ocre ferreuse s’observe donc essentiellement dans les milieux d’eau stagnante : fossés, marais, flaques d’eau permanentes en forêt, bords de plans d’eau, ruisseaux à écoulement lent. Il faut ensuite de l’eau contenant du fer ferreux (donc dissout), il s’agit le plus souvent d’une eau qui a séjourné longtemps sous terre dans des conditions anaérobies.
Un certain nombre de conditions doivent être réunies pour que l’ocre ferreuse se forme. Il faut d’abord une eau stagnante ou qui coule très lentement. L’ocre ferreuse s’observe donc essentiellement dans les milieux d’eau stagnante : fossés, marais, flaques d’eau permanentes en forêt, bords de plans d’eau, ruisseaux à écoulement lent. Il faut ensuite de l’eau contenant du fer ferreux (donc dissout), il s’agit le plus souvent d’une eau qui a séjourné longtemps sous terre dans des conditions anaérobies.
Lorsque cette eau va arriver à l’air libre, un ou plusieurs processus peuvent se déclencher.
Si l’eau n’est pas trop acide (pH autour de la neutralité 6-7), ce qui est le plus fréquent, le dioxygène présent dans l’air va oxyder (en quelques minutes) le fer dissous contenu dans l’eau et précipiter pour former l’ocre ferreuse. Les bactéries aérobies qui pourraient se développer se retrouveraient très vite évincées car privée de leur substrat nutritif (le fer dissous).
Si la concentration du dioxygène dans l’eau est de l’ordre de 1mg/l alors, ce qui peut être le cas dans de l’eau stagnante des mares, des fossés, etc. alors des bactéries ferro-oxydantes micro-aérophiles vont pouvoir se développer en oxydant le fer ferreux présent dans l’eau. Elles sont alors remarquables par la présence de masses à l’aspect floculeux ou gélatineux. Il s’agit d’oxyde de fer complexé (complexe = association d'un cation métallique avec des molécules ou des ions) avec de la matière organique.
Les conditions climatiques peuvent jouer un rôle non négligeable : un temps chaud et sec prolongé avec des eaux stagnantes qui s’échauffent et perdent de l’oxygène ; l’absence prolongée de précipitations car les fortes pluies provoquent des écoulements et la mise en mouvement de l’eau qui s’oxygène ainsi qu’une dilution des substances dissoutes. Aux endroits où ponctuellement on observe parfois des dépôts conséquents, voire spectaculaires, les premières fortes pluies les font disparaître très rapidement.
 Iron ochre
Iron ochre
Iron ochre, also known as swamp rust, is a reddish/orange muddy deposit resulting from chemical or biological activity, or both. This mud contains iron hydroxide, a hydrated iron oxide called ferrihydrite, resulting from a hydrolysis and the oxidation of ferrous iron (Fe2+).
 A number of conditions must be met for iron ochre to form. First, the water must be stagnant or flow very slowly. Iron ochre is therefore mainly found in stagnant water environments: ditches, marshes, permanent puddles in forests, edges of water bodies, slow-flowing streams. Next, we need water containing ferrous iron (i.e., dissolved iron), usually water that has spent a long time underground in anaerobic conditions.
A number of conditions must be met for iron ochre to form. First, the water must be stagnant or flow very slowly. Iron ochre is therefore mainly found in stagnant water environments: ditches, marshes, permanent puddles in forests, edges of water bodies, slow-flowing streams. Next, we need water containing ferrous iron (i.e., dissolved iron), usually water that has spent a long time underground in anaerobic conditions.
When this water reaches the open air, one or more processes may be triggered. If the water is not too acidic (pH around neutral 6-7), which is most frequent, the dioxygen in the air will oxidize (in a few minutes) the dissolved iron in the water and precipitate to form iron ochre. Any aerobic bacteria that might develop would quickly find themselves deprived of their nutrient substrate (dissolved iron).
If the dioxygen concentration in the water is of the order of 1mg/l, as is the case in the stagnant water of ponds, ditches, etc., then micro-aerophilic ferro-oxidizing bacteria can develop, oxidizing ferrous iron present in the water. They are then visible in the form of flaky or gelatinous masses. It's all about iron oxide complex (complex = association of a metal cation with molecules or ions) with organic matter.
Climatic conditions can play a significant role: prolonged hot, dry weather with stagnant water that heats up and loses oxygen; prolonged absence of precipitation, as heavy rainfall causes water to flow, oxygenate and dilute dissolved substances. In places where large, even spectacular, deposits are occasionally observed, the first heavy rains make them disappear very quickly.
- - -
 Irisation
Irisation
Vous avez sans doute déjà rencontré un jour des flaques d’eau, qui présentent à leur surface une pellicule bleutée voire irisée. Ces voiles d’aspect huileux, pourrait faire croire à une pollution aux hydrocarbures, mais il s’agit d’un film naturel dont l’origine est très différente.
 Ces films sont la conséquence de l’activité d’un autre genre de ferro-bactéries micro-aérophiles. Ils sont composés de diverses substances organiques (sucres, protéines, matières grasses). Avant de proliférer dans un environnement favorable (pH autour de la neutralité, eau calme, 2 à 3 % de dioxygène dans l’eau), les bactéries s’agglomèrent et sécrètent des protéines qui leur permettent de « s’accrocher » à l’interface eau/air. La prolifération en milieu favorable de ces bactéries forme alors des colonies dont la matrice épaisse et huileuse flotte en surface.
Ces films sont la conséquence de l’activité d’un autre genre de ferro-bactéries micro-aérophiles. Ils sont composés de diverses substances organiques (sucres, protéines, matières grasses). Avant de proliférer dans un environnement favorable (pH autour de la neutralité, eau calme, 2 à 3 % de dioxygène dans l’eau), les bactéries s’agglomèrent et sécrètent des protéines qui leur permettent de « s’accrocher » à l’interface eau/air. La prolifération en milieu favorable de ces bactéries forme alors des colonies dont la matrice épaisse et huileuse flotte en surface.
L’irisation résulte de l’interférence de la lumière avec la surface du film : une partie de la lumière blanche traverse le film et une autre est renvoyée ce qui peut induire un décalage dans la propagation des différentes longueurs d’ondes qui composent la lumière blanche.
Pour différencier un film résultant de l’activité bactérienne avec une pollution aux hydrocarbures, il suffit de tremper son doigt, ou autre choses à la surface de la pellicule. S’il s’agit d’une activité bactérienne, le film va se « briser » ne se reformera pas comme une tâche d’huile ou d’essence.
 Iridescence
Iridescence
You have probably already met puddles of water, having a bluish or even iridescent film on their surface. These oily-looking veils could look like hydrocarbon pollution, but this is a natural process whose origin is very different.
 These films are the consequence of the activity of another kind of micro-aerophilic ferro-bacteria. They are composed of various organic substances (sugars, proteins, fats). Before proliferating in a favorable environment (pH around neutral, calm water, 2 to 3% dioxygen in the water), the bacteria agglomerate and secrete proteins that allow them to "cling" to the water/air interface. The proliferation of these bacteria in a favorable environment then forms colonies whose thick and oily matrix floats on the surface.
These films are the consequence of the activity of another kind of micro-aerophilic ferro-bacteria. They are composed of various organic substances (sugars, proteins, fats). Before proliferating in a favorable environment (pH around neutral, calm water, 2 to 3% dioxygen in the water), the bacteria agglomerate and secrete proteins that allow them to "cling" to the water/air interface. The proliferation of these bacteria in a favorable environment then forms colonies whose thick and oily matrix floats on the surface.
Iridescence results from the interference of the light with the surface of the film: a part of the white light crosses the film and another one is reflected which can induce a shift in the propagation of the various wavelengths which compose the white light.
To differentiate between a film resulting from bacterial activity and a hydrocarbon pollution, simply dip your finger or something else on the surface of the film. If it's bacterial activity, the film will "break up" and not reform like an oil or gasoline stain.
Références – References
Difference betweeen oxidizing agent and reducing agent
Ocre et irisations : les ferrobactéries en action
Influence de l'activité bactérienne ferro-oxydante et ferriréductrice sur …
Iron in microbial metabolims
Pour valider la cache - Logging requirements
 Aux coordonnées indiquées, dos à l'océan, observez la paroi constituées de schistes gris sombre devant vous comme sur la photo ci-dessous.
Aux coordonnées indiquées, dos à l'océan, observez la paroi constituées de schistes gris sombre devant vous comme sur la photo ci-dessous.
 At the specified coordinates, back to the ocean, look at the rock face made of dark gray schist in front of you as in the picture below.
At the specified coordinates, back to the ocean, look at the rock face made of dark gray schist in front of you as in the picture below.

- - -
 Travail à effectuer :
Travail à effectuer :
- Décrivez ce que vous voyez (en flou) le long de la paroi constituée de schistes.
- Approchez-vous d’une zone d’écoulement de l’eau et, avec votre doigt (il n’y a pas de danger), prenez un peu de la substance qui adhère à la paroi sous l’eau qui suinte. Décrivez cette substance : couleur, consistance, odeur, etc.
- Trempez une bandelette de papier tournesol, ou tout autre réactif identique, dans l’eau qui suinte de la paroi. Quelle est la valeur du pH ?
- Dans les cuvettes où stagne de l’eau ou le long de la paroi, voyez-vous une/des pellicules irisées comme décrites dans la description ?
- Proposez un processus ou une suite de processus qui, depuis du fer ferrique présent dans la roche, permet d’obtenir du fer ferrique sous forme d’ocre ferreuse et l'apparition de pellicules irisées si elles existent.
- Une photo de vous, ou d’un objet caractéristique vous appartenant, prise dans les environs immédiats (pas de photo « d’archive » svp) est à joindre soit en commentaire, soit avec vos réponses. Conformément aux directives mises à jour par GC HQ et publiées en juin 2019, des photos peuvent être exigées pour la validation d'une earthcache.
Marquez cette cache "Trouvée" et envoyez-nous vos propositions de réponses. Nous vous contacterons en cas de problème. « Trouvée » sans les réponses, sera supprimée.
Il est strictement interdit de ramasser tout minéral, roche, fossile, galet, plante… sur tout le littoral. Merci de respecter cette consigne.
- - -
 Homework:
Homework:
- Describe what you see (blurred) along the schist rock face.
- Approach an area of water flow and, using your finger ( it's safe), take a little of the substance that adheres to the rock face under the seeping water. Describe the substance: color, consistency, smell, etc.
- Dip a litmus paper strip, or other identical reagent, into the water seeping from the rock face. What is the pH value?
- What type of bacteria do you think is involved with the oxygen in the air in the oxidation of the dissolved iron in the seepage water?
- Suggest a process or a sequence of processes that, from ferric iron present in the rock, enables to get ferric iron in the form of iron ochre, and if so, explain why iridescent films appear.
- A photo of your, your GPS/cellphone or something else personnal, taken in the immediate aera (no "stock" photos please) is to be attached either as a comment or with your answers. In accordance with updated GC HQ guidelines published in June 2019, photos may be required for validation of an earthcache.
Log this cache "Found it" and send us your answers. We will contact you in case of problems. « Found it » without the answers will be deleted.
It is strictly forbidden to pick up any mineral, rock, fossil, pebble, plant... all over the coast. Please respect this instruction.