Virus šarky švestky
Virus šarky švestky (angl. plum pox virus, PPV) je nejškodlivějším a nejrozšířenějším virem peckovin v Evropě. Choroba, kterou tento virus způsobuje, se jmenuje šarka švestky a je původcem významných hospodářských ztrát. Ztráty jsou způsobeny nejen snížením výnosu plodů (velikosti a kvality), ale také zhoršením kondice a předčasným odumíráním napadených stromů. Tento virus je znám z celého území ČR a napadá téměř všechny druhy peckovin (zástupci rodu Prunus), nejvíce však napadá švestku (Prunus domestica) a špendlíky (Prunus insititia).
K přirozenému přenosu dochází působením sání mšic, z nichž nejvýznamnějšími jsou mšice broskvoňová (Myzus persicae), mšice chmelová (Phorodon humuli) a mšice slívová (Brachycaudus helichrysi). Přenos prostřednictvím mšic umožňuje šíření viru na velké vzdálenosti. Rychlost a intenzita šíření infekce PPV ve výsadbách závisí na vzdálenosti zdrojů infekce. Odstraňováním zdrojů infekce z okolí i z vlastní výsadby v prvních letech věku výsadby (mladé rostliny jsou k napadení nejvnímavější) lze rychlost šíření ve výsadbě výrazně zpomalit, ale ne zcela zamezit. Výsadba citlivých odrůd starší deseti let už bývá většinou zcela zamořená.
Virus šarky švestky je podle platné fytosanitární legislativy EU a ČR regulovaným škodlivým organismem, který je zakázáno zavlékat a rozšiřovat na území EU, pokud se vyskytuje na rostlinách rodu Prunus určených k pěstování, s výjimkou osiva.
V praktické diagnostice se nejčastěji uplatňují sérologické testy (ELISA), které jsou dostupné, rychlé a poměrně spolehlivé. Pro spolehlivé rozlišení jednotlivých kmenů PPV je však nezbytné využití molekulárních metod (polymerázová řetězová reakce – PCR, restrikční analýza – RFLP). Sledování příznaků (symptomů) je významným orientačním prvkem při hodnocení výskytu šarky v terénu a při odběru vzorků pro laboratorní rozbor a zároveň důležitým doplňkem laboratorní diagnostiky z hlediska volby nejvhodnějších testů a interpretace jejich výsledků.
Princip metody PCR
Polymerasová řetězová reakce (PCR) je molekulárně-biologická metoda založena na replikaci nukleové kyseliny (DNA); reakce je katalyzovaná tepelně stabilní polymerasou. Výsledkem PCR je obrovské množství kopii zvoleného úseku DNA. Úseky, které se mají namnožit (amplifikovat), musí být ohraničeny na začátku a na konci tzv. primery (krátkými oligonukleotidy DNA). Zvolený úsek ohraničený párem primerů se nazývá amplikon. Namnožení úseku DNA (amplifikace) pomocí PCR se využívá v molekulární biologii (amplifikace úseku DNA pro účely dalších manipulací), k diagnostice infekčních nebo dědičných chorob nebo také k identifikaci osob či organismů.
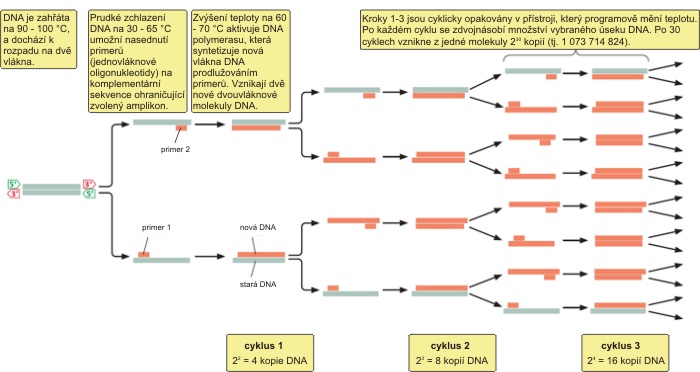
Postup
V devadesátých letech minulého století byly vyvinuty a optimalizovány metody detekce PPV pomocí PCR. Běžně používané páry primerů mají následující sekvence:
Wetzel et al. (1991):
P1 (5′-ACC GAG ACC ACT ACA CTC CC-3′)
P2 (5′-CAG ACT ACA GCC TCG CCA GA-3′)
Levy and Hadidi (1994):
3′NCR sense (5′-GTA GTG GTC TCG GTA TCT ATC ATA-3′)
3′NCR antisense (5′-GTC TCT TGC ACA AGA ACT ATA ACC-3′).
Pro PCR je třeba připravit směs s následujícím složením (celkový objem 25 µl): 1 μM primer (P1/P2 nebo 3′NCR sense/antisense), 250 μM deoxyribonukleotidy, 1 U reverzní transkriptasy AMV, 0.5 U DNA polymerasy Taq, 2.5 μl pufru Taq (10x konc.), 1.5 mM MgCl2, 0.3% Triton X-100 a 5 μl templátové RNA (vzorek).
Amplifikace se provádí dle následujícího programu: 45 min při 42 °C, 2 min při 94 ºC, 40 cyklů 30 s při 94 °C, 30 s při 60 °C (P1/P2 primery) nebo 62 °C (3′NCR primery), a 1 min při 72 °C, ukončené finální extenzí 10 min při 72 °C. Amplifikovaná DNA je analyzována pomocí gelové elektroforézy. Amplifikace pomocí primerů P1/P2 vytvoří amplikon o velikosti ABC bp, amplifikace pomocí 3′NCR primerů amplikon o velikosti DEF bp.
Jak na keš
- Zjisti velikost amplikonů při použití obou zmiňovaných párů primerů (čísla ABC a DEF). K výsledku se lze dobrat minimálně třemi způsoby:
- Využít on-line nástroj PRIMER-BLAST (http://www.ncbi.nlm.nih.gov/tools/primer-blast), vybrat správnou databázi (např. "chromosomes of all organisms") a odečíst velikost amplikonu.
- Využít některý z mnoha virtuálních PCR nástrojů, např. http://www.bioinformatics.org/sms2/pcr_products.html, kde je třeba vložit sekvenci kompletního genomu PPV a primery.
- Provést rešerši odborné literatury. Původní literatura uvedená na konci listingu je elektronicky opravdu obtížně dostupná, navíc jedna z nich obsahuje chybu (o jednotku bp), takže tento postup je nejpracnější.
- Zjisti počet švestek (stromů) v pokusném sadu na pozemku Univerzity Palackého v Olomouci (číslo XY). Letecké mapy neukazují reálný stav, proto je nutné místo navštívít osobně. Stromy rostou v pravidelném sponu, stačí vynásobit strany.
- Vypočti souřadnice finálky a navštiv ji.
- N 49° (BC-10).(B+C)(X-E)(D*E-1)
- E 17° (A+B+D+X).(X+Y)(D*E)(A-D)
Zdroje
- Levy, L. & Hadidi, A. 1994. A simple and rapid method for processing tissue infected with plum pox potyvirus for use with specific 3′ non-coding region RT-PCR assays. Bulletin OEPP/EPPO Bulletin, 24: 595–604.
- Maiss E., Timpe U., Brisske A., Jelkmann W., Casper R., Himmler G., Mattanovich D. & Katinger H.W. 1989. The complete nucleotide sequence of plum pox virus RNA. Journal of General Virolology, 70: 513-24.
- Wetzel, T., Candresse, T., Ravelonandro, M. & Dunez, J. 1991. A polymerase chain reaction assay adapted to plum pox potyvirus detection. Journal of Virological Methods, 33: 355–365.
- Kompletní nukleotidová sekvence PPV je dostupná na serveru NCBI na adrese http://www.ncbi.nlm.nih.gov/nuccore/9626508?report=fasta
Poděkování
Za důkladnou recenzi, připomínky a betatest děkuji uživateli DRT_ol