Vítám vás u další keše ze série Chemické hádanky. Ostatní keše z této série můžete nalétz skrz odkazy níže.
Chemické Hádanky I
Chemické Hádanky V-Bonus
Chemické Hádanky III
Chemické Hádanky II
Tentokrát se dozvíme něco o strukturních vlastnostech molekul. Jak jsme si v keši Chemické hádanky III vysvětlili, jednotlivé molekuly se dají popsat spoustou identifikátorů. Nebylo tomu tak ovšem vždy. Jak se zlepšovaly analytické medoty, vědci postupně zjišťovali, že jsou molekuly složitější, než se očekávalo, a je nutno je popisovat opravdu pečlivě. Záměna dvou velice podobných molekul totiž může mít až fatální následky. U molekul existují strukturní odlišnosti, které dramaticky mění jejich chemické i fyzikální vlastnosti, a přitom vypadá molekula velmi podobně, ne-li na oko stejně. Mluvíme zde o izomerii molekul.
Izomerii můžeme rozdělit do dvou forem: Konstituční izomerie a Stereoizomerie
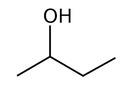
Konstituční (Strukturní) izomerie je ta očividná varianta: Napíšeme-li sumární vzorec C4H10O, můžeme si pod ním představit hned několik molekul, které budou tento sumární vzorec splňovat. V tomto případě butan-1-ol a butan-2-ol. Ale variant jsou spousty.

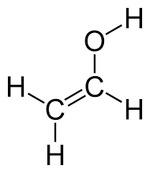
Podkategorií konstituční izomerie jsou také tautomery. Ty narozdíl od předchozího případu, nemění uspořádání atomů (kromě vodíku), nýbrž pozici násobné vazby, a tím i funkčnost molekuly. V tomto případě vinylalkohol a acetaldehyd. Tautomery mohou mezi jednotlivými formami přecházet v závislosti na podmínkách a ve spojistosti s obrázkem níže mluvíme o takzvané keto-enol tautomerii molekul.

Stereoizomerie, neboli prostorová izomerie je oproti tomu trošku složitější problematika a vyžaduje už i trochu prostorové představivosti.
Obecně stereoizomery dělíme na dvě skupiny: Enantiomery a Diastereomery.
Důležitou vlastností stereoizomerů je, že se v těchto molekulách nijak neliší uspořádání jednotlivých atomů v molekule s ohledem na uhlovodíkový řetězec. Jde zde pouze o konfiguraci na daných uhlících. I taková malá odchylka má ovšem na vlastnosti molekul zásadní vliv. Pokud mluvíme o stereoizomerii, porovnáváme molekuly vůči sobě. Jedním společným jmenovatelem stereoizomerů je název Chirální sloučeniny. Obecnou informací, kterou je nutno zmínit je, že pokud posuzujeme chiralitu látky, tak uvažujeme pouze o jedné konkrétní látce s jednou konkrétní konfigurací, zatímto pokud uvažujeme o pojmech diastereomery či enantiomery, porovnáváme vždy dvě látky vůči sobě.
Chirální sloučeniny jsou sloučeniny, ve kterých se nachází alespoň jedno chirální (stereogenní) centrum. Takové centrum je v drtivé většině případů atom uhlíku, který má 4 různé "sousedy" napojené jednoduchými vazbami. Těmito sousedy se myslí další atomy, funkční skupiny, celé části molekuly atd. Kterýmkoliv směrem se daný uhlík podívá (pokud by měl oči) musí vidět odlišné okolí a to nejen na vzdálenost pouze 1 vazby. Rozdíl může být někdy vidět až s drobnou vzdáleností. Zároveň platí, že chirální látka není pomocí operací symetrie (rovina symetrie, střed symetrie, rotace) ztotožnitelná se svým zrcadlovým obrazem. Achirální látky jsou přesným opakem, tudíž jsou ztotožnitelné se svým zrcadlovým obrazem a obecně mají rovinu nebo střed symetrie. Speciálním případem achirální sloučeniny jsou látky, které mají chirální centra a přesto jsou ztotožnitelné se svými obrazy. Takové achirální látky nazýváme meso-sloučeniny. Z podstaty věci je vlastností chirálních center přítomnost více možných konfigurací, jakými se dají jednotliví "sousedé" prostorově poskládat. Celkový maximální počet konfigurací molekuly obsahující chirální centra je 2n, kde n je počet chirálních center v molekule. Pokud je u dané sloučeniny možnost existence meso-sloučeniny (dle správné konfigurace chir. center), je celkový počet konfigurací menší než 2n, jelikož jsou minimálně dvě z možností konfigurace ve skutečnosti totožné (jsou ztotožnitelnými zdrcadlovými obrazy).
Nejlepší bude ukázat si chiralitu na konkrétní molekule: Molekulou je alanin a jeho dvě enantiomerní formy.

Asi jste si také všimli zvláštního druhu vazby, která je zobrazena jako černý trojúhelník, nebo trojúhelník čerchovaný. Tyto styly vazeb se používají právě pro tyto případy, kdy je vhodné lépe znázornit prostorové uspořádání molekuly. Plný trojúhelník znázorňuje směr vazby dopředu, tedy jakoby k nám, zatímco čerchovaný znázorňuje směr vazby dozadu, tedy od nás. Ostatní nezvýrazněné vazby molekuly leží v jedné rovině. Jak vidíme, existují dvě varianty molekuly alaninu, které jsou na první pohled stejné, ovšem záhy zjistíme, že stejné nejsou. A zde přichází nařadu problematika, ke které vás v tomto listingu směřuji.
Rozdíl mezi diastereomery a enantiomery.
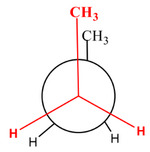
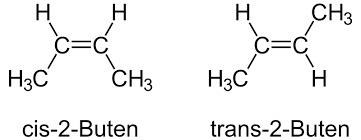
Diastereomery jsou dvě molekuly, které nejsou svými zrcadlovými obrazy. To je sice vada na kráse, ale vědcům tím ulehčují práci. Zároveň platí, že oba diastereomery mohou, ale nemusí být vždy chirální! Díky tomu, že nejsou dané dvě látky přesnými odrazy, mají odlišné jak fyzikální, tak chemické vlastnosti. Dalšími variantami diastereomerů jsou ještě tzv. konformery (rotamery) a geometrické izomery. O těch se dnes ale déle rozepisovat nebudeme, postačí je ukázat vizuálně.
Např: Molekula butanu CH3-CH2-CH2-CH3 může "zamrznout" v těchto konformacích.
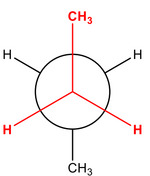
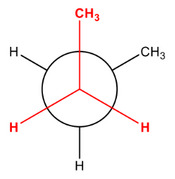
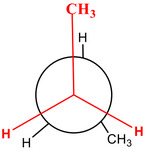
A v případě geometrichých izomerů mluvíme o rigidním stavu, kde se sloučenina nemůže otočit podél vazby C=C, a tudíž jsou zde vždy dvě varianty konfigurace.
Oproti tomu enantiomery jsou dvě látky, které jsou svými zrcadlovými obrazy, například jako výše zmíněný alanin. Důležité u enantiomerů je fakt, že jsou vždy bez výjimky chirálními sloučeninami. Zároveň platí, že tyto zrcadlové obrazy nelze žádnou operací symetrie (rotace, rovina symetrie, střed symetrie) ztotožnit. Můžeme si to přirovnat k pravé a levé ruce, jelikož je to naprosto stejný případ. Takovéto dvě molekuly mají bohužel fyzikální i chemické vlastnosti v podstatě totožné. Jedním znatelným rozdílem je stáčivost roviny polarizovaného světla, kterou mají dva enantiomery opačnou.
Pořád vám to splývá? Pochopili jste rozdíl mezi diastereomery a enantiomery? Pokud ne, pomůže další obrázek.

Obecně nám chirální látky, ať ve formě diastereomerů, nebo enantiomerů, dělají v chemii vrásky, ovšem v biochemii a medicinální chemii to platí dvojnásob. Enantiomerní chirální látky totiž byly, a někdy stále ještě jsou, příčinou mnohých lékařských průšvihů. Jako jeden příklad za všechny můžeme uvést látku s názvem Thalidomid. Ta se vyskytuje díky jednomu chirálnímu centru ve dvou verzích. Zatímco varianta R, která byla používána jako sedativum a hypnotikum pro těhotné ženy, varianta S má dle provedeného výzkumu teratogenní a karcinogenní účinky. Tento lék se pod názvem Contergan užíval zejména v 60. letech a kvůli jeho účinkům se narodilo více jak 15 000 postižených dětí, kterým chyběly ruce, uši, nebo byly jinak znetvořené. Později se přišlo i na to, že se v lidském těle mezi sebou obě enantiomerní varianty relativně jednoduše "překlápí", a tudíž není možno zajistit přítomnost jen jedné formy. Vyřešilo se to nakonec až upravením samotné struktury molekuly chemickou cestou tak, aby se jedna z variant (R) doslova "zamkla", a zůstala tudíž bezpečná, zatímco její anestetické účinky zůstaly nezměněny. A když už jsme tu použili označení R a S, tak je záhodno to i vysvětlit. Tyto označení jsou určovány pro každé jedno chirální centrum v molekule, aby byla jasná jeho konfigurace a nedocházelo tak k záměnám. Jak se toto označení stanovuje by bylo na další povídání a pro nás nyní není podstatné. Jedna podstatná informace je ta, že enantiomery mají všechna chirální centra v opačné konfiguraci, zatímco diastereomery mají alespoň jedno shodné.

Dost už ale povídání, dnes jsme tu kvůli luštění keše!
Asi jste už pochopili, že s chiralitou si není radno zahrávat, a tudíž se nyní vžijte do kůže výzkumníků a zamezte budoucím potížím! Čeká na vás 19 látek, u kterých musíte rozhodnout, zdali se jedná o látku chirální či achirální. Pokud to určíte správně, zachráníte tak kešku před smutkem z prázdného logbooku. A jako obvykle vám pro další postup v luštění pomůže šifra, která je pod obrázkem se sloučeninami. V tomto případě lze ale keš vyluštit i bez ní, takže ji přijměte jako takový dobrovolný hint, pokud si nebudete vědět rady. Při správném nápadu vám vyplyne heslo, které zadáte do ověřovače. Pokud budete luštit správně, tak obdržíte souřadnice.

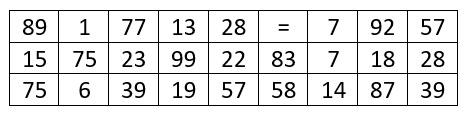

Ps: Tento výklad neslouží jako učivo chemie a pro jednoduchost vysvětlení není vždy 100% přesný! Pro kompletní objasnění celé problematiky je zapotřebí pár hodin vysvětlování. K vyluštění vám tento popis ale bohatě stačí :)