Aquäduktenmarmor oder "Travertin selbst gebaut" EarthCache
Aquäduktenmarmor oder "Travertin selbst gebaut"
-
Difficulty:
-

-
Terrain:
-

Size:  (not chosen)
(not chosen)
Please note Use of geocaching.com services is subject to the terms and conditions
in our disclaimer.
Aquäduktenmarmor oder “Travertin
selbstgebaut”

Einleitung:
Dieser Cache soll sich mit der Entstehung von Travertin
beschäftigen, der, wenn er wie hier als Folge eines Eingriffs in
die Natur durch den Menschen entsteht / entstanden ist, auch als
Aquäduktenmarmor, Kanalmarmor oder Eifelmarmor
bezeichnet wird. Voraussetzung für die Entstehung von Travertin ist
ein hartes, d.h. stark kalkhaltiges, Quellwasser, wie es von den
Römern für die Einspeisung in ihre Wasserleitung verwendet wurde.
(Das kalkhaltige Eifelwasser galt bei den Römern als hochwertig).
Dieses Aquädukt-System (lat. aqua = Wasser, ducere =
leiten) war von etwa 80n Chr. bis zur Plünderung Kölns durch die
Germanen 260n. Chr in Betrieb.
1) Wie entsteht Travertin chemisch?
2) Welche Rückschlüsse kann man in Bezug auf die
Travertin-Wachstumsgeschwindigkeit ziehen?

Bild © by Marcus Schweiß
1) Wie entsteht Travertin chemisch?
Genau genommen handelt es sich bei Travertin nicht um Marmor, wie
die oben genannten Trivialnamen vermuten lassen könnten, sondern um
einen Kalkstein, der im Gegensatz zum Marmor keiner Metamorphose
durch hohe Drücke und Temperaturen unterworfen worden ist.
Er besteht aus dem Carbonatanion CO32- und
Calciumkationen Ca2+, wobei die letzteren auch durch
Magnesiumkationen (Mg2+) ersetzt worden sein können. Der
Einfachheit halber soll dieser Umstand aber vernachlässigt werden.
Daraus ergibt sich die Formel CaCO3.
Ob sich ein ionischer Stoff noch in Wasser löst oder nicht,
bestimmt sein Löslichkeitsprodukt (KL). Es gibt die
maximale Konzentration der Ionen an, die in Wasser erreicht werden
kann und ist abhängig von der Temperatur.
KL = c(CO32-) ·
c(Ca2+)
Wird dieses Löslichkeitsprodukt überschritten, fällt fester
Kalkstein aus und zwar so lange bis sich die Konzentration der
Ionen wieder im Rahmen des Löslichkeitsprodukts befindet.
Wie kann es sein, dass das Löslichkeitsprodukt überschritten
wird?
Dafür kann es drei Ursachen geben:
a) Verdunstung: Das Wasser wird weniger. Dadurch wird zwar
kein Einfluss auf die Anzahl der Ionen genommen, aber durch die
Verringerung des zur Verfügung stehenden Lösungsmittelvolumens
erhöht sich die Ionenkonzentration. (Derselbe Vorgang lässt sich
bei einem handelsüblichen Wasserkocher auch in der eigenen Küche
beobachten.  )
)
b) Temperaturerhöhung: Wie oben erwähnt ist das
Löslichkeitsprodukt KL keine unabhängige Konstante,
sondern abhängig von der Temperatur. Im Falle von CaCO3
bedeutet dies, dass die Löslichkeit mit steigender Temperatur
sinkt. → Je wärmer das Wasser wird, desto mehr
CaCO3 fällt aus. Da das Quellwasser in der Regel kälter
ist als die Umgebungsluft, setzt dieser Vorgang sofort bei Austritt
an die Oberfläche ein - im Sommer stärker, im Winter schwächer.
(Auch dieser Vorgang ist ursächlich für die Ablagerungen im
Wasserkocher und zum Leidwesen aller Waschmaschinenbesitzer auch in
derselbigen ).
).
c) Kohlenstoffdioxid: In der Umgebungsluft, mit der das
Quellwasser nach Austritt in Kontakt kommt, befindet sich
Kohlenstoffdioxid. Zu Zeiten der Römer zwar weit weniger, als
heute, aber der Effekt bleibt der gleiche: Kohlenstoffdioxid löst
sich in Wasser und verbindet sich gemäß CO2 +
H2O → 2H+ + CO32-
zu Carbonatanionen, was deren Konzentration ebenfalls erhöht. Im
Falle von stark kalkhaltigem Wasser verläuft dieser Vorgang jedoch
möglicherweise sogar in die umgekehrte Richtung, sodass er hier
eher zu vernachlässigen ist. (Dennoch kennt man ihn vielleicht aus
dem Chemieunterricht als Kalkwasserprobe)
Damit entstand dieser Travertin auf dieselbe Art und Weise, wie
auch der Travertin, der bei Tivoli (lat. = Tibur) für den
Bau der Peterskirche und des Kolosseums abgebaut wird/wurde -
nämlich durch Ausfällung. Er unterscheidet sich dadurch von den
meisten anderen Kalkgesteinen, die durch die Überreste kalkhaltiger
Meerestiere gebildet wurden (Muschelkalk).
Von diesem Abbaugebiet leitet sich auch der lateinische Name
lapis tiburtinus (Tiburtinischer Stein), der sich im Verlauf
der Sprachgeschichte zu Travertin weiterentwickelte.
2) Welche Rückschlüsse kann man in Bezug auf das
Travertin-Wachstumsgeschwindigkeit ziehen?
Die Beantwortung dieser Frage ist deine (Log-)Aufgabe:
1) Bestimme die Oberfläche des Travertinquerschnitts am
Eingang des Aquädukts so exakt, wie es dir möglich ist [in
cm2]. Ein Zollstock o. Ä. ist dafür sehr empfehlenswert.
Die Nichtmathematiker dürfen näherungsweise je ein Dreieck an der
rechten und linken Seite des Aquädukts annehmen. Siehe Bild.
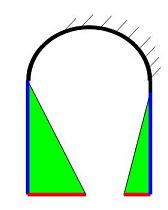 (Die Fläche (A) eines
Dreiecks berechnet sich nach: A =
Breite·Höhe/2)
(Die Fläche (A) eines
Dreiecks berechnet sich nach: A =
Breite·Höhe/2)
2) Berechne, wie viele cm2 des
Travertinquerschnitts sich danach pro Jahr gebildet haben.
3) Mache, wenn du möchtest, ein Foto von dir/deinem GPS vor
Ort. 
Sende die Antworten auf die Fragen 1) und 2) über mein Profil an
mich und du erhältst so schnell es geht, eine Logerlaubnis.
Viel Spaß wünscht
Miraculix84
PS: Dieser Cache lässt sich gut mit 225m
ü. NN. - auf den Spuren der Römer kombinieren.
Weiterführende Literatur:
Hollemann/Wiberg: Lehrbuch der anorganischen Chemie, Berlin
2007.
Wikipedia:
Aquäduktenmarmor
Wikipedia:
Eifelwasserleitung





Calc-sinter or travertine done by yourself

Introduction:
This cache shall deal with the genesis of travertine. A
precondition for the genesis of travertine is a very hard spring
water, as it was used by the ancient Romans for feeding their
aqueduct (see photo). The Romans appreciated the hard spring water
from Eifel. The aqueduct was in operation from 80 A.D. to 260 A.D.,
when Germanic peoples despoiled Cologne.
1) How does travertine grow, seen from a chemical point of
view?
2) What conclusions can be drawn from this relating to the rate of
increase of travertine?

Bild © by Marcus Schweiß
1) Travertine is just a special modification of lime, which
is composed of CO32- und Ca2+.
Normaly parts of Ca2+ are replaced by Mg2+,
but to simplify matters this shall be disregarded here. So the
chemical notation is CaCO3.
If a ionic substance is soluble in water is defined by it’s
solubility product KL:
KL = c(CO32-) ·
c(Ca2+)
It is indicating the maximum concentration of ions in water and is
depending on temperature.
If the solubility product is overspent, lime (here: travertine) is
precipitated until the solubility is reached agin. That’s the
way travertine grows, but why is the solubility product overspent?
It hadn’t been overspent, when the water left the
spring.
There are three reasons:
a) Evaporation: Water is evaporating, as soon as it has left
the spring. This doesn’t change the amount of ions, but their
concentration. So the more water is evaporating, the more
travertine is generated. (You can watch this phenomenon also in
your kitchen: Have a look into your electric kettle! )
)
b) Increase of temperature: As written above the solubility
product is not an independent constant, it depends on temperature:
An increasing temperature causes a decreasing solubility product.
So the warmer the water becomes, the more travertine is generated.
As spring water is usually cold, the process starts as soon as
water leaves the spring. (You can watch this phenomenon also in
your electric kettle, but, in contrast to the evaporation,
travertine caused by increase of temperature can also be watched in
your washing machine! So this is the phenomenon your plumber is
most grateful for - it safeguards his job!  )
)
c) Carbon dioxide: In the atmosphere is carbon dioxide. This
is soluble in water and produces CO32-:
CO2 + H2O → 2H+ +
CO32-. So carbon dioxide causes an increase
of the concentration of CO32- - ions. But in
case of very hard spring water this process can also proceed in the
other direction. So we should be allowed to neglect it here.
So this travertine was generated right the same way, as the
travertine in Tivoli (lat: Tibur), which was used for
Colosseum and St Peter’s Basilica in Rom, was generated, too
- just without an aqueduct having been built - by chemical
precipitation. That’s what distinguishes travertine from most
other kinds of lime, which emerged from the rests of fossils.
By the way the name travertine has its origin in the city
Tivoli (lat: Tibur), as Romans called it lapis
tiburtinus (stone from Tivoli). Over the years lapis
tiburtinus developed into travertine.
2) What can we guess about the rate of increase of travertine by
this?
That’s your task for logging this cache:
1) Determine the cross sectional area of the travertine on
both sides of the aqueduct in cm2 as well, as it is
possible for you. Use a folding ruler or the like! You are allowed
to approximate the two cross section areas as triangles.
 (The formula for calculating the surface area (A) of a triangle is:
A = width·height/2)
(The formula for calculating the surface area (A) of a triangle is:
A = width·height/2)
2) Calculate, how many cm2 of travertine cross
section were generated each year.
3) Take a photo (optionally), to prove, that you have been
here indeed.
Send the answers of the task 1 and 2 to me via my profil and you
will get the permission to log as soon as possible! 
Have fun!
Miraculix84
PS: This Cache can easyly be combined with 225m
ü. NN. - auf den Spuren der Römer.
Further literature:
Hollemann/Wiberg: Lehrbuch der anorganischen Chemie, Berlin
2007.
Wikipedia:
Aquäduktenmarmor
Wikipedia:
Eifelwasserleitung

Additional Hints
(Decrypt)
Jraa qh nhpu mh qrara truöefg, qvr rure qra Uvag nyf qra Grkg yrfra:) Mbyyfgbpx zvgaruzra!