From the guidelines, as from January 2013: "People do not need to wait for permission to log your EarthCache. Requiring someone to wait is not supported by the EarthCache guidelines. People should send their logging task answers to you, then log your EarthCache. When you review their logging task answers, if there is a problem, you should contact them to resolve it. If there is no problem, then their log simply stands."

The concept of pH was first introduced by Danish chemist S. P. L. Sørensen at the Carlsberg Laboratory in 1909. Sørensen suggested the notation "PH" for convenience, standing for "power of hydrogen", using the negative logarithm of the concentration of hydrogen ions in solution.
pH is the measure of the acidity or alkalinity of a solution. It is formally a measure of the activity of dissolved hydrogen ions (H+), but for very dilute solutions, the molarity (molar concentration) of H+ may be used as a substitute with little loss of accuracy. In solution, hydrogen ions occur as a number of cations including hydronium ions (H3O+).
 Acid mine drainage (AMD), or acid rock drainage (ARD), refers to the outflow of acidic water from (usually) abandoned metal mines or coal mines.
Acid mine drainage (AMD), or acid rock drainage (ARD), refers to the outflow of acidic water from (usually) abandoned metal mines or coal mines.
Occurrence - Sub-surface mining often progresses below the water table, so water must be constantly pumped out of the mine in order to prevent flooding. When a mine is abandoned, the pumping ceases, and water floods the mine. This introduction of water is the initial step in most acid rock drainage situations. Tailings piles or ponds may also be a source of acid rock drainage.
After being exposed to air and water, oxidation of metal sulphides (often pyrite, which is iron-sulfide) within the surrounding rock and overburden generates acidity. Colonies of bacteria and archaea greatly accelerate the decomposition of metal ions, although the reactions also occur in an abiotic environment. These microbes, called extremophiles for their ability to survive in harsh conditions, occur naturally in the rock, but limited water and oxygen supplies usually keep their numbers low. Special extremophiles known as acidophiles especially favor the low pH levels of abandoned mines. In particular, Acidithiobacillus ferrooxidans is a key contributor to pyrite oxidation.
Metal mines may generate highly acidic discharges where the ore is a sulphide or is associated with pyrites. In these cases the predominant metal ion may not be iron but rather zinc, copper, or nickel. The most commonly-mined ore of copper, chalcopyrite is itself a copper-iron-sulfide and occurs with a range of other sulfides. Thus, copper mines are often major culprits of ARD.
Chemistry - The chemistry of oxidation of pyrites, the production of ferrous ions and subsequently ferric ions, is very complex, and this complexity has considerably inhibited the design of effective treatment options.
Although a host of chemical processes contribute to AMD, pyrite oxidation is by far the greatest contributor. A general equation for this process is:
2FeS2(s) + 7O2(g) + 2H2O(l) ? 2Fe2+(aq) + 4SO42-(aq) + 4H+(aq)
The oxidation of the sulfide to sulfate solubilizes the ferrous iron (iron(II)), which is subsequently oxidized to ferric iron (iron(III)):
4Fe2+(aq) + O2(g) + 4H+(aq) ? 4Fe3+(aq) + 2H2O(l)
Either of these reactions can occur spontaneously or can be catalyzed by microorganisms that derive energy from the oxidation reaction. The ferric irons produced can also oxidize additional pyrite:
FeS2(s) + 14Fe3+(aq) + 8H2O(l) ? 15Fe2+(aq) + 2SO42-(aq) + 16H+(aq)
The net effect of these reactions is to release H+, which lowers the pH and maintains the solubility of the ferric ion.
 Achada do Gamo
Achada do Gamo
Achado do Gamo forms part of the old São Domingos Mine complex and was the site of a sulphur processing plant. Here the ore was cooked in large furnaces (still visible today) by a process known as ustulation in order to generate sulphuric acid.
Here the AMD visible doers not stem from the reaction of suphide minerals with water at depth but rather from the reaction of the ore lying on the surface as a result of the handling of it for transformation in the processing plant and the rain.
To claim this cache you have to collect a sample of the AMD fluids present in the lagoon (careful so you don’t fall in) and measure the pH of this fluid. The proof will be in the photo that you attach to the log (taken on site) that proves you were there and such that the pH value obtained is visible to all. There is no need to send any answers prior to logging the cache but your log should include the photo.
To measure the pH you have three options:
- Buy (an expensive, electronic) pH meter and use it. I warn you in advance that the pH of that fluid will probably render it useless for any further use. I know because I have sent three to the scrap heap.
- Get hold of some indicator paper and measure the pH.
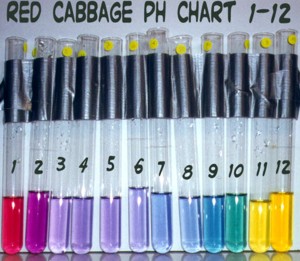
- Or you can become an alchemist and can make some red cabbage extract to measure the pH. The pigment in red cabbage is known for its ability to change colors depending on the pH (level of acidity) that it comes in contact with. To manufacture it you will need distilled water and red cabbage. Cut about a third of a red cabbage into smaller pieces and place it a pot with approximately 150 ml of distilled water (it is important that you use distilled water because it is free of dissolved salts). Bring it to boil vigorously and then turn the heat down to simmer. Add more water if needed and boil the mixture for about 10 minutes until the water turns purple. Turn off the heat, let it cool and then filter the mixture through some filter paper. Bottle the mixture and you have “indicator fluid” ready for claiming the EarthCache. (Please note that the fluid will stain clothes so be careful in the handling of it). After collecting your AMD sample, add a few drops of the red cabbage extract and compare the colour obtained to the image below to obtain your pH value. Take a picture and upload it with your log.

If in summer you find the lagoon dry due to evaporation, you can collect your sample at the nearby stream:
N37º 38.951 W7º 30.724. You'll be surprised at the results obtained.
Sources: Here, here and here. Fernando Fortes is thanked for the red cabbage "recipe".

O pH refere-se a uma medida que indica se uma solução líquida é ácida (pH < 7), neutra (pH = 7), ou básica/alcalina (pH > 7). Uma solução neutra só tem o valor de pH = 7 aos 25 °C.
pH é o símbolo para a grandeza físico-química 'potencial hidrogeniônico'. Essa grandeza indica a acidez, neutralidade ou alcalinidade de uma solução líquida.
 O termo pH foi introduzido, em 1909, pelo bioquímico dinamarquês Søren Peter Lauritz Sørensen (1868-1939) com o objetivo de facilitar seus trabalhos no controle de qualidade de cervejas (à época trabalhava no Laboratório Carlsberg, da cervejaria homónima). O "p" vem do alemão potenz, que significa poder de concentração, e o "H" é para o ião de hidrogénio (H+).
O termo pH foi introduzido, em 1909, pelo bioquímico dinamarquês Søren Peter Lauritz Sørensen (1868-1939) com o objetivo de facilitar seus trabalhos no controle de qualidade de cervejas (à época trabalhava no Laboratório Carlsberg, da cervejaria homónima). O "p" vem do alemão potenz, que significa poder de concentração, e o "H" é para o ião de hidrogénio (H+).
Drenagem ácida de minas (DAM) é a solução aquosa ácida gerada quando minerais de sulfuretos presentes em resíduos da extracção mineira são oxidados na presença de água. Trata-se de um dos mais graves impactos ambientais associados à actividade mineira.
Esta solução age como agente lixiviante dos minerais presentes no resíduo produzindo um percolado rico em metais dissolvidos e ácido sulfúrico. Caso o percolado alcance corpos hídricos próximos pode contaminá-los tornando-os impróprios para o uso por um longo tempo, mesmo após cessadas as actividades de mineração. A DAM pode ocorrer quando o mineral ou metal de interesse nas operações de lavra encontra-se associado a sulfuretos. A ocorrência de DAM tem sido relatada na extracção de ouro, carvão, cobre, zinco ou urânio, entre outros, bem como na disposição inadequada dos resíduos destas operações. Evitar que as superfícies de rejeitos e/ou estéreis que contém minerais de sulfuretos fiquem expostas à condições oxidantes em presença de água é fundamental para a prevenção e minimização da DAM.
 A oxidação dos sulfuretos, e consequente acidificação das águas que percolam as áreas de disposição de resíduos, é inicialmente uma reacção de cinética lenta. Pode porém ser catalisada por processos microbiológicos que actuam principalmente quando o pH da água atinge valores inferiores a 3,5.
A oxidação dos sulfuretos, e consequente acidificação das águas que percolam as áreas de disposição de resíduos, é inicialmente uma reacção de cinética lenta. Pode porém ser catalisada por processos microbiológicos que actuam principalmente quando o pH da água atinge valores inferiores a 3,5.
O ácido produzido durante a oxidação dos sulfuretos pode ser consumido em reacções com outros componentes naturais presentes no resíduo tais como os carbonatos e aluminosilicatos. A matéria orgânica eventualmente presente nos estéreis e rejeitados de mineração tem também potencial para retardar a DAM. Além de competir com os sulfuretos pelo consumo de oxigénio, a matéria orgânica, ao se oxidar, produz gás carbónico (CO2), que expulsa o oxigénio dos poros do resíduo. A reduzida precipitação pluviométrica é também um factor inibidor da DAM.
De forma simplificada e tomando como exemplo o de mineral de sulfuretos, a pirite, o processo de geração de DAM pode ser representado pela equação:
4 FeS2 + 15 O2 + 14 H2O = 4Fe(OH)3 + 8 H2SO4
A pirite pode também ser oxidada pela acção do ião férrico (Fe3+) em solução em um processo denominado oxidação indirecta. Trata-se de uma reacção rápida desde que exista Fe3+ em concentração suficiente. A concentração de iões férricos em solução, por sua vez, depende do pH e da acção de bactérias, especialmente as do tipo Thiobacillus Ferrooxidans. Estas podem acelerar a produção de Fe3+ a partir de Fe2+ em mais de cinco vezes em relação aos sistemas puramente abióticos, favorecendo portanto a geração de DAM.
Para efectuarem o found desta cache vão ter que recolher uma amostra das águas na lagoa da Achada do Gamo e medir o seu pH (o pH desta lagoa varia sasonalmente). A prova consistirá na foto (tirada no local) que juntarem ao log da cache que claramente indica o valor do pH medido. Não é necessário enviar respostas por mail.
Para efectuarem as medicões têm 2 opções:
1 – comprem um medidor de pH electrónico e usem-no para efectuar a devida medição. Aviso: Eu já mandei 3 para o lixo depois de mergulhar o eléctrodo naquela lagoa.
2 – Arranjem papel indicador e efectuem a medição,
3 - ou podem optar por um método mais divertido e fabricar o vosso próprio líquido indicador de pH.
 Para o fazerem sigam esta receita:
Para o fazerem sigam esta receita:
Ingredientes:
- 1 Couve roxa
- 150 a 250 ml de água destilada
Forma de cozinhar
- Cortem aproximadamente 1/3 da couve roxa aos bocadinhos e coloquem-nos numa panela.
- Adicionar 150 ml de água destilada. (notem que é importante usar água destilada porque não contém sais dissolvidos. Estes podem dar origem a medições erradas).
- Cozer a mistura durante 10 minutos em lume forte até a água ficar roxa. Caso a água evapore, acrecentem mais um pouco.
- Deixar arrefecer a mistura.
- Filtrar o extracto de couve roxa para um frasco – este extracto mancha portanto cuidado com a roupa, etc.
Levem a vossa mistura ao local, colham a amostra, adicionem uns pingos do extracto de couve e voilá! Anotem a cor consoante a tabela de pH em cima, tirem-lhe a foto e já está. Fácil e divertido.
Se no verão a lagoa da Achada estiver seca devido à evaporação, recolham a água na ribeira:
N37º 38.951 W7º 30.724. De certeza que ficarão admirados com os resultados obtidos.
Fonte: aqui e aqui. Agradeço ao Fernando Fortes a "receita" de couve roxa.
Divirtam-se!
 The most exciting way to learn about the Earth and its processes is to get into the outdoors and experience it first-hand. Visiting an Earthcache is a great outdoor activity the whole family can enjoy. An Earthcache is a special place that people can visit to learn about a unique geoscience feature or aspect of our Earth. Earthcaches include a set of educational notes and the details about where to find the location (latitude and longitude). Visitors to Earthcaches can see how our planet has been shaped by geological processes, how we manage the resources and how scientists gather evidence to learn about the Earth. To find out more click HERE.
The most exciting way to learn about the Earth and its processes is to get into the outdoors and experience it first-hand. Visiting an Earthcache is a great outdoor activity the whole family can enjoy. An Earthcache is a special place that people can visit to learn about a unique geoscience feature or aspect of our Earth. Earthcaches include a set of educational notes and the details about where to find the location (latitude and longitude). Visitors to Earthcaches can see how our planet has been shaped by geological processes, how we manage the resources and how scientists gather evidence to learn about the Earth. To find out more click HERE.

